一种甾体化合物的24位取代基由
α
构型转位成
β
构型的方法
技术领域
1.本发明涉及药物化学合成技术领域,更具体地,涉及一种甾体化合物24位的取代基由α构型转位成β构型的方法。
背景技术:
2.油菜素内酯(brassinolide,bl)是20世纪70年代从自然界分离鉴定的一系列超微量内源性植物生长调节剂中的活性最强者,其广谱、高效、安全,生物活性和生理功能与其他已发现的五类植物生长调节剂完全不同。油菜素内酯是植物生长发育所必需的基本调节物质,普遍存在于植物体中,调控着各种植物的生长发育过程。同时有报道,油菜素内酯对人体前列腺增生有着较好的抑制活性,是一种潜在的新药分子。
[0003][0004]
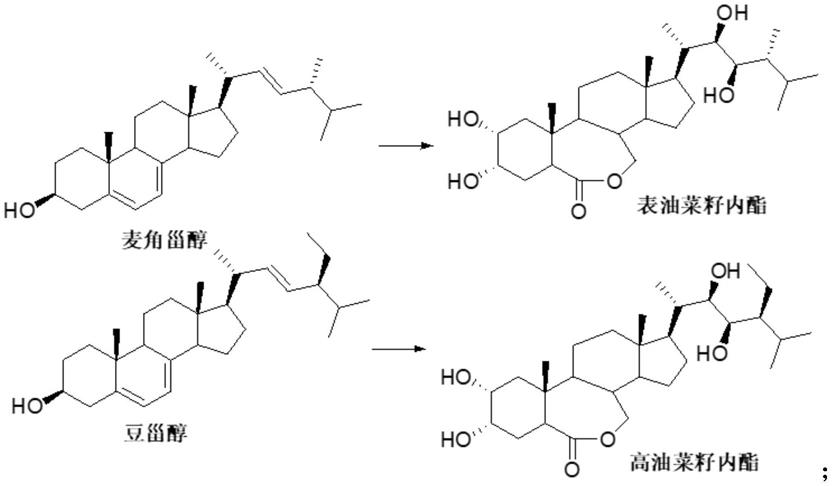
自1970年j.w.mitchell发现油菜素内酯及其高生理活性后,其深受世界各国关注,都希望应用于农业生产。由于其重要的作用,各科研工作者一直寻求有效的获取途径。传统的方法都是从油菜花粉中提取,但是含量非常低,科研工作者grove、mandava等人从227kg油菜(brassica napus)花粉中才提取出4mg的高活性结晶物。由于它在植物体内含量太低,萃取工艺复杂,成本太高,从植物体里分离油菜素内酯,再用于农田,曾被认为是行不通的。各国纷纷研究化学合成天然油菜素内酯(天然芸苔素)及其类似物。
[0005]
有报道可较容易的获得天然油菜素内酯的类似物—表油菜素内酯和高油菜素内酯:
[0006][0007]
但是天然油菜素内酯的合成相对困难,主要难点在于其侧链的手性构造,特别是24位β甲基的构建。也有少数报道经过多步骤寿星合成来合成天然油菜素内酯的方法,如:can.j.chem.vol.71.1993,合成路线如下:
[0008]
然而该方法每一步都存在手性的选择性问题,收率低,分离困难,而且起始原料也较难获得。
技术实现要素:
[0009]
基于现有技术中存在的上述技术问题,本发明提供了一种甾体化合物的24位取代基由α构型转位成β构型的方法,通过将该衍生物经与酸或碱发生烯酮化反应,可以使24位取代基由α构型转位成β构型。
[0010]
为了实现上述目的,本发明的技术方案如下:
[0011]
化合物i的24位取代基由α构型转位成β构型的方法,该方法为:所述化合物i与酸或碱发生烯醇化反应,使所述取代基从α构型转位成β构型;其中,所述化合物i为下述结构之一:
[0012][0013]
其中,r1为c
1-3
烷基、烯基、h、羟基中的一种,r2为甲基、乙基、丙基、吡啶、苯基中的一种;r3和r4各自独立为c
1-3
烷基、h、保护基团中的一种,r5为c
1-3
烷基、h中的一种。
[0014]
在一些实施方式中,所述酸为盐酸、硫酸、三氟乙酸和高氯酸中的至少一种;所述碱为甲醇钠、叔丁醇钠、钠氢、dbu中的至少一种。
[0015]
在一些实施方式中,反应温度为0~10℃。
[0016]
本发明还提供了化合物ii的24位取代基由α构型转位成β构型的方法,其特征在于,先将23位或25位羟基氧化成酮,然后与酸或碱发生烯醇化反应,使所述取代基从α构型转位成β构型;其中,所述化合物ii为下述结构之一:
[0017][0018]
其中,r6为c
1-3
烷基、烯基、h、羟基中的一种,r7为甲基、乙基、丙基、吡啶、苯基中的一种;r8和r9各自独立为c
1-3
烷基、h、保护基团中的一种,r
10
为c
1-3
烷基、h中的一种。
[0019]
在一些实施方式中,化合物ii的24位取代基转位的反应中,所用酸为盐酸、硫酸、三氟乙酸和高氯酸中的至少一种;所用碱为甲醇钠、叔丁醇钠、钠氢、dbu中的至少一种。
[0020]
在一些实施方式中,化合物ii的24位取代基转位的反应中,与所述酸或碱反应时的反应温度为1~10℃。
[0021]
在一些实施方式中,先将r8或r9氧化成酮的方法为:将化合物b在氧化试剂作用下发生氧化反应;所述氧化剂为戴斯-马丁氧化剂。
[0022]
在一些实施方式中,r8或r9氧化成酮的反应温度为1~10℃。
[0023]
相较于现有技术,本发明的有益效果如下:
[0024]
使用本发明的方法,可快速将甾体化合物上侧链的24位取代基由α构型转位为β构型,克服了现有技术中甾体化合物侧链手性构造困难的缺陷,而且反应条件简单,制备工艺简单,为药物的化学合成中侧链取代基的α构型向β构型的转位提供了新方法。
具体实施方式
[0025]
在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施的限制。
[0026]
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
[0027]
本发明旨在提供一种甾体化合物的24位取代基由α构型转位成β构型的方法,该方法包括将具有式i结构的化合物a或具有式ii结构的化合物b与酸或碱反应,使所述取代基从α构型转位成β构型的步骤;
[0028][0029]
其中,r1为c
1-3
烷基、烯基、h、羟基中的一种,r2为甲基、乙基、丙基、吡啶、苯基中的一种;r3和r4各自独立为c
1-3
烷基、h、保护基团中的一种,r5为c
1-3
烷基、h中的一种。
[0030]
具体方法为:在氮气保护下,将所述化合物原料、溶剂(四氢呋喃)加入反应容器中,搅拌溶解,冰浴下降温至0~5℃,然后将酸或碱加入所述反应容器中,保温继续搅拌反应2~3h;反应完毕,滴入纯净水淬灭反应;接着加入浓盐酸和水,继续搅拌反应使水解完毕,调节ph至6~7,浓缩有机溶剂至干,加入萃取剂萃取,分液,无水硫酸镁干燥,接着硅胶柱层析,乙酸乙酯-石油醚梯度洗脱,得到转位后的化合物。
[0031]
具体地,所述酸为盐酸、硫酸、三氟乙酸和高氯酸中的至少一种;所述碱为甲醇钠、叔丁醇钠、钠氢、dbu(1,8-二氮杂双环[5.4.0]十一碳-7-烯)中的至少一种,反应温度为0~10℃。由于酸转位发生更多副反应,不利于产物分离,优选碱性条件转位,更优选的,使用叔丁醇钾,反应溶剂为四氢呋喃。
[0032]
本发明还提供了另一结构的甾体化合物的24位取代基由α构型转位成β构型的方法,该方法包括将具有式iii结构的化合物c或具有式iv结构的化合物d先经过23位羟基氧化成酮后,再与酸或碱反应,使所述取代基从α构型转位成β构型的步骤;
[0033][0034]
其中,r6为c
1-3
烷基、烯基、h、羟基中的一种,r7为甲基、乙基、丙基、吡啶、苯基中的一种;r8和r9各自独立为c
1-3
烷基、h、保护基团中的一种,r
10
为c
1-3
烷基、h中的一种。
[0035]
具体方法包括以下步骤:
[0036]
1)将化合物c或化合物d、溶剂(二氯甲烷)和碱混合,开启搅拌,冰浴下降温至0~10℃,然后加入戴斯-马丁试剂;反应完毕,过滤,滤饼用二氯甲烷洗涤,所得滤液加入5%亚硫酸钠溶液洗涤,分液,再加入水洗涤,分液,有几层浓缩至干,得到23位或25位氧化后的化合物;
[0037]
2)在氮气保护下,将步骤1)得到的23位或25位氧化后的化合物原料、溶剂(四氢呋喃)加入反应容器中,搅拌溶解,冰浴下降温至0~5℃,然后将酸或碱加入所述反应容器中,保温继续搅拌反应2~3h;反应完毕,滴入纯净水淬灭反应;接着加入浓盐酸和水,继续搅拌反应使水解完毕,调节ph至6~7,浓缩有机溶剂至干,加入萃取剂萃取,分液,无水硫酸镁干燥,接着硅胶柱层析,乙酸乙酯-石油醚梯度洗脱,得到转位后的化合物。
[0038]
具体地,所述酸为盐酸、硫酸、三氟乙酸和高氯酸中的至少一种;所述碱为甲醇钠、叔丁醇钠、钠氢、dbu中的至少一种,反应温度为0~10℃。由于酸转位发生更多副反应,不利于产物分离,优选碱性条件转位,更优选的,使用叔丁醇钾,反应溶剂为四氢呋喃。
[0039]
具体地,将r8或r9氧化成酮的方法为:将化合物b在氧化试剂作用下发生氧化反应;所述氧化剂为戴斯-马丁氧化剂,反应温度为1~10℃。
[0040]
下面以油菜素内酯的合成为例具体说明本发明的方案。如下述实施例1,从已有的
商业化起始原料表油菜素内酯出发,经2,3位羟基保护之后,直接将23位羟基氧化成酮,再与碱反应将24α-甲基转位为24β-甲基,有效获得天然油菜素内酯,路线短,反应绿色环保,而且收率高,克服了传统的全合成过程中侧链手性构造困难、步骤多、收率低的缺陷。
[0041]
实施例1
[0042]
天然油菜素内酯的制备方法,包括以下步骤:
[0043]
s1、缩酮反应:在带有磁子的反应瓶中加入10g表油菜素内酯、30ml二氯甲烷和10ml二丁醇缩丙酮,搅拌均匀,氮气保护下,加入0.5g催化剂对甲苯磺酸吡啶盐,室温反应3h,tlc检测基本反应完全,加入1ml三乙胺,浓缩二氯甲烷,接着加入20ml乙酸乙酯,继续浓缩,至大量固体析出;然后降温至0~5℃继续搅拌1h;过滤,滤饼用乙酸乙酯洗涤,在40℃下干燥,得8.2g缩酮物(化合物a),重量收率82%;反应路线如下:
[0044][0045]
s2、氧化反应:在反应瓶中加入5g缩酮物、25ml二氯甲烷和1g碳酸氢钠,开启搅拌,冰浴下降温至0~10℃,然后将5g戴斯-马丁试剂分5次等量加入,每次加入间隔10min;反应完毕,过滤,滤饼用二氯甲烷洗涤,所得滤液加入5%亚硫酸钠溶液洗涤,分液,再加入水洗涤,分液,有机层浓缩至干得4.5g化合物b,重量收率45%,所得化合物b直接用于下一步反应;本步骤的反应路线为:
[0046][0047]
s3、转位反应:氮气保护下,带磁子的反应瓶中加入4g化合物b、40ml四氢呋喃,搅拌溶解,冰浴下降温至0~5℃,称取2.4g叔丁醇钾快速加入至反应瓶中,保温继续搅拌反应2h;反应完毕,降温至-10~5℃,缓慢滴入10ml纯净水淬灭反应;然后加入4ml浓盐酸和10ml水,继续搅拌反应1h,水解完毕,调节ph至6-7,浓缩有机溶剂至干,加入二氯甲烷20ml萃取,分液,无水硫酸镁干燥,接着硅胶柱层析,乙酸乙酯石油醚梯度洗脱,得1.6g化合物c,收率40%,回收1g化合物b;反应路线为:
[0048][0049]
s4、还原反应:带磁子的反应瓶中加入1g化合物c、5ml四氢呋喃和5ml甲醇溶解,冰浴下降温至0~5℃,加入六水氯化铈0.1g,搅拌均匀,然后加入0.1g硼氢化钠,保温反应5h,反应完毕,滴加10%盐酸淬灭,反应放出气体,继续搅拌10min;在不超过50℃下减压浓缩有机溶剂至干,加入氯仿20ml溶解,水10ml*2洗涤两次,分液,浓缩氯仿,加入乙酸乙酯20ml继续浓缩至2ml,静置结晶,得0.3g天然油菜素内酯,母液继续浓缩结晶得0.16g产物,重量收率24%;反应路线为:
[0050][0051]
步骤s4浓缩结晶后所得产物核磁氢谱和碳谱分别如下所示:
[0052]1h nmr(400mhz,cdcl3)δ4.10(t,j=8.3hz,2h),4.03(d,j=11.9hz,1h),3.70(d,j=13.8hz,2h),3.40(d,j=4.9hz,1h),3.12(dd,j=12.1,4.2hz,1h),2.43
–
2.12(m,5h),2.01
–
1.73(m,7h),1.59
–
1.45(m,5h),1.30
–
1.18(m,6h),0.97(d,j=6.5hz,3h),0.92
–
0.83(m,12h),0.71(s,3h)。
[0053]
13
c nmr(101mhz,cdcl3)δ176.40,76.52,72.71,70.61,68.30,68.24,58.33,52.75,51.42,42.65,41.64,41.61,41.06,40.42,39.75,39.37,38.48,31.21,27.86,27.19,24.93,22.40,22.29,17.46,15.63,12.56,11.80,11.01。
[0054]
需要说明的是,步骤s3中的反应路线,实际是包括了24位取代基的转位反应以及2,3位的水解反应,转位完成后直接加入浓盐酸与水进行水解,使位于2,3位的保护基团脱除得到羟基。
[0055]
实施例2
[0056]
制备高油菜素内酯的方法,包括以下步骤:
[0057]
1)转位反应:氮气保护下,带磁子的反应瓶中加入4g化合物b、40ml四氢呋喃,搅拌溶解,冰浴下降温至0~5℃,称取2.0g甲醇钠快速加入至反应瓶中,保温继续搅拌反应2h;反应完毕,降温至-10~0℃,缓慢滴入10ml纯净水淬灭反应;然后加入5ml浓盐酸和20ml水,继续搅拌反应1h,水解完毕,调节ph至6-7,浓缩有机溶剂至干,加入二氯甲烷20ml萃取,分液,无水硫酸镁干燥,接着硅胶柱层析,乙酸乙酯石油醚梯度洗脱,得1.6g化合物c1,收率36%;反应路线为:
[0058][0059]
还原反应:带磁子的反应瓶中加入1g化合物c1、10ml四氢呋喃和5ml甲醇溶解,冰浴下降温至0~5℃,加入六水氯化铈0.1g,搅拌均匀,然后加入0.12g硼氢化钠,保温反应5h,反应完毕,滴加10%盐酸淬灭,反应放出气体,继续搅拌10min;在不超过50℃下减压浓缩有机溶剂至干,加入氯仿20ml溶解,水10ml*2洗涤两次,分液,浓缩氯仿,加入乙酸乙酯20ml继续浓缩至2ml,静置结晶,得0.3g天然油菜素内酯,母液继续浓缩结晶得产物,重量收率20%;反应路线为:
[0060][0061]
如无特别说明,本发明实施例中所用的化学试剂为市购或现有方法制备;所用浓盐酸浓度20~37%。
[0062]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0063]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
