1.本发明涉及一种显示质膜和溶酶体的探针,尤其涉及一种同时显示质膜和溶酶体的双靶向探针及其优于以往只能观察显示一种物质的探针成像的应用。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.众所周知,细胞是生物体的基本单位,许多生物学家和医学家竞相分析细胞的结构。细胞由质膜和各种细胞器组成,形成细胞器相互作用网络作为功能区域。相互作用网络中,质膜是阻止细胞外物质自由进入细胞,确保细胞内环境相对稳定的屏障。同时,细胞内许多重要的生理活动都发生在质膜上,如胞吞作用、胞吐作用和信号转导等。此外,溶酶体是一种ph值为4.0-5.5的酸性细胞器,充当废物处理系统,并消化细胞质中的废物或未使用的物质。许多研究表明溶酶体和质膜在分泌、质膜修复、信号传递等多种生物过程中相互合作。例如,溶酶体可视为ca
2+
调节的外细胞室,负责质膜修复。此外,溶酶体已被鉴定为成纤维细胞损伤质膜再修复的关键细胞器。因此,研究质膜与溶酶体的关系对相关生物学研究具有重要意义。
4.近年来,荧光探针由于其独特的选择性、近无损检测、实时、快速、准确等优点,在生物分析中得到了广泛的应用。用荧光探针观察质膜与溶酶体的相关性是一种很好的方法。迄今为止,共染色实验通常通过使用两种不同的荧光探针来同时成像和分析它们之间的关系。spuul的小组通过使用zsgreen和lysotracker red可视化了质膜和溶酶体之间的融合过程。此外,andrews及其同事通过免疫共染色方法证明,质膜修复受到溶酶体释放的蛋白酶的调节。此外,w
ü
stner等人结果表明,niemann pick c2蛋白可以通过这种方式触发胆固醇(cl)从溶酶体转移到质膜外排。共染色实验在质膜与溶酶体关系的研究方面取得了很大进展。但这两种探针具有不同的摄取速率和代谢特征,这可能妨碍它们实现同时成像。发明人之前设计了一种空间分布可控的单分子荧光探,染色位置为细胞质膜和线粒体,但进一步研究发现:该单分子荧光探无法满足同时对质膜和溶酶体进行成像的要求。
技术实现要素:
5.针对现有技术的不足,本发明要解决的问题是提供一种同时显示质膜和溶酶体的双靶向探针。
6.为实现上述技术目的,本发明采用如下技术方案:
7.本发明的第一个方面,提供了一种同时可视化质膜和溶酶体的双靶向荧光探针,所述双靶向荧光探针为式(i)所示结构的化合物,其化学名称为:(e)-4-(2-(6-(二甲氨基)萘-2-基)乙烯基)-1-十八烷基吡啶-1-碘化铵;
[0008][0009]
本发明基于双靶向基团构建了探针mem-lyso,设计了一种能同时染色质膜和溶酶体的探针,能够同时对质膜和溶酶体进行成像。
[0010]
研究过程中,为了使探针分子在细胞内所标记的位置准确地定位为细胞质膜和溶酶体,同时,对细胞质膜和溶酶体染色后的荧光亮度和稳定性都比较好,以满足双色同时可视化成像的要求。本发明在空间分布可控型荧光探针pmm-me的基础上,尝试了多种不同官能团的修饰方案,发现:通过烷基修饰增加侧链的长度后,得到的探针mem-lyso不仅能够对细胞质膜和溶酶体进行同时染色,而且染色后的荧光亮度和稳定性都比较好,在较低的损耗激光能量之下就能够采集到细胞质膜和溶酶体超高分辨率图像。
[0011]
本发明的第二个方面,提供了一种同时可视化质膜和溶酶体的双靶向荧光探针的制备方法,包括:
[0012]
将化合物2即4-甲基-1-十八烷基吡啶-1-碘化铵溶解在有机溶剂中,再加入化合物4即6-(二甲氨基)-2-萘醛,和哌啶,进行反应,得到得到(e)-4-(2-(6-(二甲氨基)萘-2-基)乙烯基)-1-十八烷基吡啶-1-碘化铵,即探针mem-lyso。
[0013]
本发明的第三个方面,提供了上述的双靶向荧光探针在跟踪和分析不同生物过程中质膜和溶酶体动态变化中的应用。
[0014]
本发明的第四个方面,提供了上述的双靶向荧光探针在将生物体的质膜和溶酶体分别标记为红色和黄色中的应用,优选地,所述生物体为斑马鱼。
[0015]
本发明的第五个方面,提供了上述的双靶向荧光探针在空间区分质膜中胆固醇含量中的应用。
[0016]
本发明的有益效果在于:
[0017]
(1)本发明首次设计了一种能同时标记质膜和溶酶体的双靶向探针(mem-lyso)。探针mem-lyso利用双靶向技术,成功探索了不同生物过程中质膜与溶酶体的相关性。实验结果表明,与正常状态相比,细胞凋亡过程中质膜与溶酶体之间存在明显的融合。此外,由于对极性的敏感性,mem-lyso可以在细胞的质膜和溶酶体上分别标记红色和黄色。进一步观察了这两个细胞器在活斑马鱼体内的相对位置。更重要的是,mem-lyso的双靶标特性使其具有空间区分质膜胆固醇(cl)含量的能力,这在生物学研究和相关疾病的诊断中具有重要意义。
[0018]
(2)本发明所述的可以同时显示质膜和溶酶体的双靶向探针为相关疾病的生物学研究和诊断提供了潜在的检测工具。
[0019]
(3)本发明的操作方法简单、成本低、具有普适性,易于规模化生产。
(二甲氨基)-2-萘醛(0.177g,0.754mmol)和哌啶(6滴)。添加完成后,提高温度并回流至红棕色固体析出,得到(e)-4-(2-(6-(二甲氨基)萘-2-基)乙烯基)-1-十八烷基吡啶-1-碘化铵,即探针mem-lyso。
[0034][0035]
本发明所述同时显示质膜和溶酶体的双靶向荧光探针mem-lyso在跟踪和分析不同生物过程中质膜和溶酶体动态变化的应用。
[0036]
其中:所述活细胞为永生化siha和hela细胞。
[0037]
本发明所述双靶向荧光探针mem-lyso在检测或显示质膜和溶酶体动态变化的应用。
[0038]
本发明所述双靶向荧光探针mem-lyso可以同时在质膜和溶酶体上分别标记为红色和黄色的应用。
[0039]
下面结合具体的实施例,对本发明做进一步的详细说明,应该指出,所述具体实施例是对本发明的解释而不是限定。
[0040]
实施例1
[0041]
mem-lyso的合成与表征
[0042]
将化合物2即4-甲基-1-十八烷基吡啶-1-碘化铵(0.357g,0.754mmol)和无水甲醇(25ml)加入三个烧瓶中,55℃加热至全部溶解,再加入化合物4即6-(二甲氨基)-2-萘醛(0.177g,0.754mmol)和哌啶(6滴)。添加完成后,提高温度并回流至红棕色固体析出,得到(e)-4-(2-(6-(二甲氨基)萘-2-基)乙烯基)-1-十八烷基吡啶-1-碘化铵,mem-lyso,0.22g,产率45%。
[0043]1h nmr(dmso-d6.,300mhz):δ(ppm):8.80(d,j=8hz,2h),8.11(d,j=8hz,2h),8.02(d,j=16hz,1h),7.91(s,1h),7.67(m,3h),7.39(d,j=16hz,1h),7.17(m,1h),6.88(s,1h),4.37(d,j=16hz,2h),2.98(s,6h),1.16(m,32h),0.76(d,j=12hz,3h).hrms(m/z):calcd for c
37h55
in2:654.34;found:527.44(m-i)
+
.
[0044]
实施例2
[0045]
mem-lyso的光学性能测试
[0046]
首先,选取极性不同的色谱纯溶液作为溶剂,本实验选用了1,4-二氧六环、thf和dmf等7种溶剂。向其中分别加入5μl的探针分子母液,配制为最终浓度为10μm的探针分子溶液。然后采集其吸收和荧光光谱,并对其最大发射峰位进行分析,得到其吸收和发射光谱的数据,并计算斯托克斯位移、摩尔吸光系数、荧光量子效率等光物理参数。
[0047]
结果见图1。
[0048]
图1:mem-lyso在不同溶剂中的吸收光谱(a)、荧光光谱(b)和归一化荧光光谱(c)。浓度:10μm。
[0049]
实施例3
[0050]
染色活细胞
[0051]
根据最初的设计,探针mem-lyso可以靶向细胞内的质膜和溶酶体。为了验证这一特性,首先使用mem-lyso对活细胞进行染色,看看它是否能同时对质膜和溶酶体进行成像,结果如图2所示。从图2中,细胞的轮廓有绿色荧光绘制,证明mem-lyso可以精确的成像质膜。
[0052]
结果见图2。
[0053]
图2:用mem-lyso染色的siha和hela细胞的荧光图像、dic和它们的叠加图像(2μm,10min)。λ
ex
=488nm,λ
em
=500-600nm,bar=20μm。
[0054]
实施例4
[0055]
同时标记细胞质膜与溶酶体
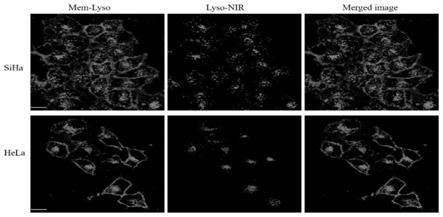
[0056]
为了进一步证明细胞质中的荧光斑点确实来自溶酶体,需要进行mem-lyso和传统溶酶体探针lyso-nir之间的共定位实验。在共定位实验之前,研究了mem-lyso和lyso-nir的吸收光谱和荧光光谱。得知mem-lyso不能被633nm激发,lyso-nir不能被488nm激发。因此,图3的绿色仅来自mem-lyso,红色仅来自lyso-nir。如图3所示,在细胞质中,lyso-nir的红色与mem-lyso的绿色很好地重合,siha和hela细胞中的共定位系数分别为0.89和0.90。此外,细胞周围也有绿色荧光,表明memlyso可以同时染色活细胞中的质膜和溶酶体。
[0057]
结果见图3。
[0058]
图3:用mem-lyso(2μm,10min)和lyso-nir(0.2μm,30min)染色的siha和hela细胞的荧光图像,以及它们的合并图像。mem-lyso:λ
ex
=488nm,λ
em
=500-560nm,lyso-nir:λ
ex
=635nm,λ
em
=655-700nm,bar=20μm
[0059]
实施例5
[0060]
探讨不同生物过程中质膜与溶酶体的关系
[0061]
1)本发明进一步跟踪了这两种细胞器在细胞凋亡过程中的动态变化。选择h2o2溶液孵育细胞诱导凋亡,然后观察质膜和溶酶体动态。如图4所示,加入h2o
2 5min后,细胞质中的溶酶体开始向质膜移动,这可能是由于溶酶体需要通过质膜清除细胞坏死部分。
[0062]
结果见图4。
[0063]
图4:用mem-lyso(2μm,10分钟)染色,然后用h2o2溶液孵育不同时间的hela细胞的荧光图像,以及它们的合并图像,λ
ex
=488nm,λ
em
=500-600nm,bar=20μm。
[0064]
2)由于成分和功能的不同,质膜和溶酶体之间的微环境也不同。siha和hela都与mem-lyso一起孵育,然后进行λ模式的真实彩色成像实验。如图5所示,等离子体膜和溶酶体分别呈现红色和黄色,最大原位发射峰分别为625nm和592nm。这一结果进一步表明质膜的极性略高于溶酶体的极性。
[0065]
结果见图5。
[0066]
图5:用mem-lyso(2μm,10分钟)染色的siha和hela细胞的实时彩色荧光图像和相应的原位发射光谱,λ
ex
=488nm,λ
em
=500-690nm,bar=20μm。
[0067]
3)用探针mem-lyso可视化活体斑马鱼的质膜和溶酶体。如图6中a所示,斑马鱼的骨架被mem-lyso染色,斑马鱼内部也显示出明亮的荧光。为了证明溶酶体在斑马鱼体内的位置,进行了实彩色成像。从图6中b看,斑马鱼的整个骨骼呈红色发射,从斑马鱼内部也有
亮黄色荧光(白色箭头),表明斑马鱼的溶酶体位于头部下方,靠近身体侧面。此外,图6中c的原位发射光谱证明斑马鱼的质膜和溶酶体的极性与siha和hela细胞相似。
[0068]
结果见图6。
[0069]
图6:用mem-lyso(2μm,2h),λ
ex
=488nm,λ
em
=500-600nm(a检测时的λ
em
)和λ
em
=500-690nm(b检测时的λ
em
),染色的斑马鱼(一周)的荧光(a)、真彩色图像(b)和相应的原位光谱(c),bar=500μm。
[0070]
实施例6
[0071]
检测质膜上胆固醇的含量
[0072]
1)考虑到cl对质膜流动性的影响和探针的双重靶向特性,本发明推测mem-lyso可用于通过空间分布检测质膜中的cl水平。
[0073]
2)在用饱和cl溶液处理细胞以增加质膜中的cl含量后,探针mem-lyso可以专门染色质膜。
[0074]
3)用β-cd从质膜中提取cl后,所有探针mem-lyso都靶向溶酶体,并且在质膜上没有发现荧光。
[0075]
4)利用探针mem-lyso的双重靶向特性,通过空间分布检测质膜中cl含量的变化(图7)。与传统的质谱方法相比,该方法非常直观方便。
[0076]
结果见图7。
[0077]
图7:用mem-lyso染色不同cl水平的hela细胞的荧光图像(2μm,10分钟)。λ
ex
=488nm,λ
em
=500-600nm,bar=20μm。
[0078]
最后应该说明的是,以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
