1.本发明属于新材料有机化学品技术领域,具体涉及一类新的含有以香豆素并咔唑为核心的光敏化合物,其化学制备工艺技术,其作为辐射固化光敏引发剂的用途,以及其在辐射固化配方产品,特别是在uv-vis-led光固化涂料或油墨,等诸多场合的应用用途。
背景技术:
2.光固化技术是一种利用光引发剂引发链式反应形成聚合物的技术,光固化具有节能环保,高效快速和时间-空间可控等诸多优点,已广泛应用于涂料油墨、胶黏剂等传统领域以及光刻胶、3d打印等高新技术产品中,具有能在室温下迅速反应,可以控制聚合反应仅发生在辐射区域、无挥发性有机化合物排放等很多优势。光引发剂是光固化体系中的重要部分,其波长可调性和光反应性是光固化反应过程的重点。
3.根据光引发剂被激发后产生的活性中心的种类不同(自由基或阳离子),主要可以分为自由基型光引发剂和阳离子型光引发剂,分别引发自由基聚合和阳离子聚合。与自由基固化相比,阳离子固化体系(非丙烯酸酯类)具有不易受氧气阻聚影响、固化收缩率小等优点,拓展了光固化材料研究发展的范围。阳离子光引发剂在紫外-可见光作用下,当光能大于光引发剂断键能时,产生质子酸或者路易斯酸,而形成正离子活性中心,引发聚合。此过程要求光引发剂的吸收光谱与光源的波长范围相匹配。随着工业的快速发展,对节能环保的要求也越来越高,因此光固化中传统使用的汞灯逐渐被具有高效节能的led替代,而与led光源发射波长相匹配的高效光引发剂的研究与开发逐渐成为一大热点。
4.光敏化剂是一类可以敏化其他化学物质发生光反应的一类化合物,通过吸收光子并将能量传递给那些不能吸收光子的分子,促其发生化学反应,而本身则不参与化学反应。在光固化组分中添加led敏感的染料可以有效提升配方在led 光源下的聚合速率。但由于光敏化剂无法参与光固化反应,体系固化后的这类小分子具有一定的迁移性,在实际应用中会存在一定的毒性危害,因此解决光敏化剂的迁移性是一大难点。
5.香豆素并咔唑具有大的平面共轭结构,具体的结构如下式所示:
[0006][0007]
香豆素与咔唑共轭增强了π-电子的离域性,使电子更容易被激发;含香豆素并咔唑基团的物质在365nm以上波长范围内具有良好的光吸收能力;同时,香豆素并咔唑基团也具有良好的荧光和敏化性质。另外,香豆素并咔唑基团的合成过程简便,产率高、成本低,如专利公开号cn107163169a描述,通过4-羟基咔唑和乙酰乙酸乙酯扣环即可制备。如果在分子中同时存在香豆素并咔唑基团和可聚合基团,则既可以解决引发剂的迁移性问题,也可以使吸收光谱有效的红移,同时可以与传统引发剂复配,从而对led光源的能量具有良好的
吸收。
技术实现要素:
[0008]
本发明的首要目的在于提供一类新型可阳离子引发聚合的香豆素并咔唑类光敏剂,其可以独立或者与传统硫鎓盐和碘鎓盐类光引发剂共同使用,从而引发光固化反应;且这类光敏剂具有可聚合基团,固化后与基体树脂结合,几乎不发生迁移,在led、特别使可见光led可激发的光固化涂料或油墨等诸多场合有着很强的应用前景。
[0009]
本发明的第二个目的是提供一种可阳离子引发聚合的香豆素并咔唑类光敏剂的制备方法。
[0010]
本发明的第三个目的是提供上述可阳离子引发聚合的香豆素并咔唑类光敏剂的用途。
[0011]
具体地,本发明提供下述方案:
[0012]
一种下述的式(i)所示的可阳离子引发聚合的香豆素并咔唑类光敏剂,且在香豆素部分进一步引入取代的羰基与香豆素并咔唑组成新的光敏剂,其通式如下:
[0013][0014]
在上述通式(i)化合物的结构中:
[0015]
y是含有环氧基团的可聚合基团:环氧乙烷基烷基或环氧丙烷基烷基,任选地,环氧基团与咔唑结构之间的烷基中的一个或多个-ch
2-可各自独立地被-o-、
ꢀ‑
co-、-coo-、-oco-或-o-ch
2-ch(oh)-ch
2-o-所取代。
[0016]
进一步优选地,y选自:以环氧乙烷基或环氧丙烷基为封端的c1-8的烷基,任选地,烷基中的一个或多个-ch
2-可各自独立地被-o-、-co-、-coo-、-oco
‑ꢀ
或-o-ch
2-ch(oh)-ch
2-o-所取代,且环氧乙烷基或环氧丙烷基中的h可被c
1-4
的烷基所取代。
[0017]
进一步优选地,y可选自以下结构:
[0018][0019]
z选自c
1-12
的烷基、未取代或者被1-5个r7取代的苯基、未取代或者被1
‑ꢀ
9个r7取代的稠环芳基、未取代或被1-4个r7取代的芳香杂环基、或者、未取代或者被1-8个r7取代的苯并芳香杂环基;
[0020]
r1,r2,r3,r4,r5,r6分别独立地选自被1-4个ra取代的c
1-6
的烷基、
‑ꢀ
h、-f、-cl、-br、-i、-cn、-cf2cf3、-cf3、-no2、-nrbrb、-orb、-srb、-c(=o)rb、
ꢀ‑
co2rb、-oc(=o)rb、-nrbc(=o)rb、-s(=o)rb、-s(=o)2rb;
[0021]
r7各自独立地选自未取代或者被1-5个ra取代的c
1-6
的烷基、-h、-f、-cl、
ꢀ‑
br、-i、-cn、-cf2cf3、-cf3、-no2、-nrbrb、-orb、-srb、-c(=o)rb、-co2rb、
ꢀ‑
oc(=o)rb、-nrbc(=o)rb、-s(=o)rb、-s(=o)2rb、未取代或者被1-5个rc取代的碳环,未取代或者被1-5个rd取代的杂环、或者、p(=o)(orb)2;
[0022]
ra各自独立地选自c
1-6
烷基、(ch2)
rc3-6
环烷基或者-(ch2)r苯基;
[0023]
rb各自独立地选自h、未取代或者被1-5个re取代的c
1-6
烷基、未取代或者被1-5个re取代的-(ch2)rph;
[0024]
rc各自独立地选自未取代或者被1-5个re取代的c
1-6
烷基、未取代或者被 1-5个re取代的(ch2)rph;
[0025]
rd各自独立地选自未取代或者被1-5个re取代的c
1-6
烷基、未取代或者被 1-5个re取代的(ch2)rph;
[0026]
re各自独立地选自-h、-f、-cl、-br、-i、-oh、-no2、-cn,-cf3、-cf2cf3、 c
1-4
烷基、c
1-4
烷氧基、c
3-7
环烷基、苯基、苄基、苯乙基、萘基、杂环芳基、或者、酮基;
[0027]
r各自独立地为0、1、2、3或者4;
[0028]
本发明提供一种上述的可阳离子引发聚合的香豆素并咔唑类光敏剂的制备方法,其合成路线如下:
[0029][0030]
上述制备方法中,使用的原料是现有技术中的已知化合物,可通过商业购得或者经已知的合成方法简便地制备而成。在该类化合物的制备过程包括以下步骤:
[0031]
(1)中间体(i)-a的制备
[0032]
通过与pocl3氧化反应在取代的4-羟基咔唑邻位上醛基,反应条件为dmf 做溶剂,0℃,n2保护,反应时间4h,得到中间体(i)-a;
[0033]
(2)中间体(i)-b的制备
[0034]
中间体(i)-a通过与z取代的甲酰基乙酸乙酯在碱(优选为哌啶或哌啶与吡啶混合物)的催化下进行扣环反应,反应条件为乙醇作溶剂,80℃,n2保护,反应2h,得到中间体
(i)-b;
[0035]
(3)产物(i)的制备
[0036]
中间体(i)-b通过与卤代物y-x在碱性催化剂(优选为甲醇钠、叔丁醇钠、叔丁醇钾、甲醇钾等)存在下发生反应,生成产物(i);其中,x表示卤素(优选是f、cl或br)。反应在溶剂体系中进行,对使用的溶剂种类并没有特别限定,只要能够溶解原料且对反应无不良影响即可,优选dmso、thf、dmf。反应温度通常为室温;反应时间根据原料种类略有差异,通常为2-10h。
[0037]
一种上述的可阳离子引发聚合的香豆素并咔唑类光敏剂的作为辐射固化光引发剂的用途。具体地,其作为光引发剂或其它功能性添加剂成分的用途,及在化学合成中作为中间体或原料或试剂的用途。
[0038]
该类光辐射固化配方体系的特征是:
[0039]
(1)含有至少一种通式(i)所描述的化合物与至少一种任意种类的光引发剂单独或复配使用作为配方体系中的光引发组分;
[0040]
(2)含有至少一种含环氧类或氧杂环丁烷类的可聚合化合物。
[0041]
(3)体系中可聚合组分总量每100份重量计算,上述式(i)所示的光引发剂的含量为0.5~20重量份。
[0042]
优选地,辐射固化光敏引发剂的光源的发生波长选自紫外光和可见光中的一种及以上。
[0043]
优选地,辐射固化光敏引发剂的光源选自可发射紫外光、可见光的汞灯、led 光源、ldi光源中的一种以上。
[0044]
实际上,辐射固化光敏引发剂除了包括可阳离子引发聚合的香豆素并咔唑类光敏剂和可聚合组分之外,还可以含有根据实际需要添加无机填充剂、有机填充剂、着色剂、其他添加剂和溶剂等任意组分。
[0045]
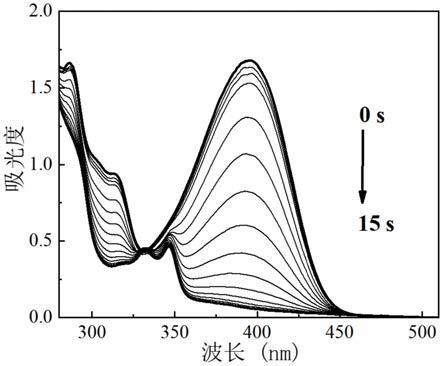
其中,着色剂选自颜料或染料。
[0046]
其他添加剂包括紫外线吸收剂、光稳定剂、阻燃剂、流平剂或消泡剂。
[0047]
具体步骤如下:(1)按单体和树脂:光引发剂:助剂的质量比100:0.5-1: 0-4.5配比原料;(2)搅拌使其充分溶解;(3)以不同波长或者不同光强的光源照射聚合体系;其中:步骤(3)中的光源可为汞灯(高压,中压和低压),以及发射波长是365-450nm的leds,ldi光源。
[0048]
作为前述的具有环氧基的单体,例如可以列举出例如单官能缩水甘油醚类、多官能脂肪族缩水甘油醚类、多官能芳香族缩水甘油醚类、缩水甘油酯类、脂肪族环氧化合物等。
[0049]
作为单官能缩水甘油醚类,例如可以列举出,烯丙基缩水甘油醚、丁基缩水甘油醚、苯基缩水甘油醚、2-乙基己基缩水甘油醚、仲丁基苯基缩水甘油醚、叔丁基苯基缩水甘油醚、2-甲基辛基缩水甘油醚等。
[0050]
作为多官能脂肪族缩水甘油醚类,可以列举出例如,1,6-己二醇缩水甘油醚、三羟甲基丙烷三缩水甘油醚、新戊二醇二缩水甘油醚、甘油二缩水甘油醚、甘油三缩水甘油醚、乙二醇二缩水甘油醚、聚乙二醇二缩水甘油醚、聚丙二醇二缩水甘油醚等。
[0051]
作为多官芳香族缩水甘油醚类,可以列举出例如,双酚a缩水甘油醚、双酚 f缩水
甘油醚、溴化双酚a缩水甘油醚、联苯酚缩水甘油醚、四甲基联苯酚缩水甘油醚、间苯二酚缩水甘油醚等。
[0052]
作为缩水甘油酯类,可以列举出例如,丙烯酸缩水甘油酯、甲基丙烯酸缩水甘油酯、邻苯二甲酸二缩水甘油酯、六氢邻苯二甲酸二缩水甘油酯等。
[0053]
作为脂肪族环氧化合物,可以列举出例如,3,4-环氧环己基甲基-3,4-环氧环己基甲酸酯、3,4-环氧环己基乙基-3,4-环氧环己基甲酸酯、乙烯环己烯基二氧化物、丙烯基环己烯基二氧化物、3,4-环氧-4-甲基环己基-2-丙烯基氧化物等。
[0054]
本发明的光固化组合物中,前述的可聚合成分也可以为低聚物或预聚物等聚合物的形式,或者是由单体、低聚物、预聚物中的至少一种形成的共聚物。另外,也可以是水性分散体的形式。
[0055]
作为前述的含环氧基的聚合物,例如可以是含有环氧基的聚合物或者树脂,如双酚a环氧树脂、二环戊二烯型环氧树脂、二氨基二苯基甲烷型环氧树脂、氨基苯酚型环氧树脂、萘型环氧树脂、酚醛清漆型环氧树脂、联苯型环氧树脂、氢化联苯型环氧树脂、脂肪式环氧树脂等。
[0056]
上述无论是环氧单体或低聚物、预聚物、或共聚物,对本专业从业技术人员而言,都是熟知的,并无特别限定。
[0057]
符合通式(i)结构的示例性化合物列举如下:
[0058]
[0059][0060]
由于采用上述方案,本发明的有益效果是:
[0061]
本发明的可阳离子引发聚合的香豆素并咔唑类光敏剂作为辐射固化光敏引发剂以及在辐射固化配方产品中应用,特别是在uv-vis-led可激发的光固化涂料或油墨等场合应用。香豆素并咔唑类分子的大共轭体系使电子离域增加,让这类分子结构的吸收峰红移到近紫外-可见光区域,从而与目前商品化的led光源的发射波长更加重叠,使激发效率得以提高。本发明的可阳离子引发聚合的香豆素并咔唑类光敏剂具有光引发效率高、溶解性好,且固化后与基体树脂结合,几乎不发生迁移,且具有光漂白效果,具有很强的应用前景。
附图说明
[0062]
图1实施例6中的配方1在405nm led激发下的紫外-可见吸收光谱
具体实施方式
[0063]
本发明提供了一种可阳离子引发聚合的香豆素并咔唑类光敏剂及其制备方法和应用。
[0064]
以下结合实施例对本发明作进一步的说明。
[0065]
实施例1:
[0066]
本实施例的可阳离子引发聚合的香豆素并咔唑类光敏剂(i)-1的制备方法包括如下步骤:
[0067][0068]
步骤(a):在0-5℃下将pocl3(4.9ml,52.00mmol)滴加到dmf(17 ml,219.53mmol)中,并在保持温度0-5℃的情况下搅拌30min。在30min 内将溶解在20ml dmf中的4-羟基咔唑(10g,47.00mmol)逐滴加入,保持温度在0-5℃之间。接下来继续搅拌20-30min,然后将反应混合物升至室温并在70-75℃下加热1h。通过tlc监测反应的完成,将所得反应物料倒入碎冰中充分搅拌并用碳酸氢钠中和。滤出所得沉淀物并干燥,随后甲苯作为洗脱液,通过硅胶柱纯化,得到(i)-1a。产率52.6%。
[0069]
步骤(b):上一步制备的(i)-1a(4g,18mmol)和乙酰乙酸乙酯(1.3g,20mmol) 溶于100ml乙醇中,加入催化剂量的哌啶,回流2h,析出亮黄色结晶化合物。通过tlc监测反应的完成。过滤反应物质,乙醇洗涤,得到(i)-1b。产率:91%。
[0070]
步骤(c):向烧瓶中加入(i)-1b(4.15g,15mmol)、碳酸钾(3.92g,28.4mmol) 及少量的碘化钾和18-冠-6做催化剂和100ml dmf做溶剂。通入氮气,接着缓慢滴加环氧氯丙烷(1.47g,16mmol),控制0.5h滴加完,在搅拌条件下,100℃油浴中反应,通过tlc监测反应的完成。将反应液倒入去离子水中,搅拌,正己烷萃取产物,无水硫酸镁干燥正己烷产物溶液,旋蒸除去正己烷,甲醇重结晶,得淡黄色固体产物(i)-1。产率:88%。hr-ms(c
20h15
no4):m/e:333.1161;实验结果:334.1248(m+h+)。
[0071][0072]
实施例2:化合物(i)-2至(i)-12的制备
[0073]
这些化合物的制备方法与(i)-1基本相同,区别是在步骤(b)中使用的取代的甲酰乙酸乙酯不同,从(i)-2至(i)-12分别使用如下结构式通式所示的(1)甲氧基甲酰乙酸乙酯、(2)2-呋喃甲酰乙酸乙酯、(3)2-噻吩甲酰乙酸乙酯、(4)2-吡咯甲酰乙酸乙酯、(5)苯甲
酰乙酸乙酯、(6)邻甲基苯甲酰乙酸乙酯、(7)4-氟苯甲酰乙酸乙酯、(8)4-氯苯甲酰乙酸乙酯、(9)4-硝基苯甲酰乙酸乙酯、(10)4-三氟甲基苯甲酰乙酸乙酯、(11)3-(4-甲氧苯基)-3-氧代丙酸乙酯,制备出的中间体经过完全一样的反应步骤制备出目标产物。
[0074]
(i)-2,三步总产率:65%,hr-ms:m/e:349.1317;实验结果:350.1394(m+h
+
)。
[0075]
(i)-3,三步总产率:64%,hr-ms:m/e:385.1474;实验结果:386.1562(m+h
+
)。
[0076]
(i)-4,三步总产率:70%,hr-ms:m/e:401.1630;实验结果:402.1707(m+h
+
)。
[0077]
(i)-5,三步总产率:68%,hr-ms:m/e:384.1943;实验结果:385.2020(m+h
+
)。
[0078]
(i)-6,三步总产率:65%,hr-ms:m/e:395.1474;实验结果:396.1561(m+h
+
)。
[0079]
(i)-7,三步总产率:65%,hr-ms:m/e:405.1524;实验结果:406.1661(m+h
+
)。
[0080]
(i)-8,三步总产率:65%,hr-ms:m/e:413.1317;实验结果:414.1394(m+h
+
)。
[0081]
(i)-9,三步总产率:64%,hr-ms:m/e:429.1214;实验结果:430.1782(m+h
+
)。
[0082]
(i)-10,三步总产率:70%,hr-ms:m/e:440.1630;实验结果:441.1707(m+h
+
)。
[0083]
(i)-11,三步总产率:68%,hr-ms:m/e:463.1943;实验结果:464.2020(m+h
+
)。
[0084]
(i)-12,三步总产率:65%,hr-ms:m/e:425.1474;实验结果:426.1561(m+h
+
)。
[0085]
实施例3:化合物(i)-13至(i)-24的制备
[0086]
这些化合物的制备方法与相应的(i)-1至(i)-12前两步骤完全相同,区别是在步骤(c)中用3-(溴甲基)-3-乙基氧杂环丁烷代替环氧氯丙烷从而制备出目标产物。
[0087]
(i)-13,三步总产率:64%,hr-ms:m/e:375.1693;实验结果:376.1764(m+h
+
)。
[0088]
(i)-14,三步总产率:65%,hr-ms:m/e:391.2006;实验结果:392.2078(m+h
+
)。
[0089]
(i)-15,三步总产率:70%,hr-ms:m/e:427.1563;实验结果:428.1647(m+h
+
)。
[0090]
(i)-16,三步总产率:65%,hr-ms:m/e:443.1787;实验结果:444.1868(m+h
+
)。
[0091]
(i)-17,三步总产率:62%,hr-ms:m/e:426.2100;实验结果:427.2720(m+h
+
)。
[0092]
(i)-18,三步总产率:69%,hr-ms:m/e:437.1630;实验结果:438.1160(m+h
+
)。
[0093]
(i)-19,三步总产率:63%,hr-ms:m/e:451.1943;实验结果:452.1124(m+h
+
)。
[0094]
(i)-20,三步总产率:59%,hr-ms:m/e:455.2256;实验结果:456.2234(m+h
+
)。
[0095]
(i)-21,三步总产率:61%,hr-ms:m/e:471.1787;实验结果:472.1867(m+h
+
)。
[0096]
(i)-22,三步总产率:65%,hr-ms:m/e:482.1536;实验结果:483.1628(m+h
+
)。
[0097]
(i)-23,三步总产率:62%,hr-ms:m/e:505.1849;实验结果:506.1920(m+h
+
)。
[0098]
(i)-24,三步总产率:69%,hr-ms:m/e:467.1380;实验结果:468.1460(m+h
+
)。
[0099]
《实验》
[0100]
以上述实施例的产品分别进行如下实验。
[0101]
实施例4:led光固化实验以及涂料性质测试
[0102]
含环氧基团和氧杂环丁烷基团样品体系按下列配方制作(以重量百分比计)
[0103]
单官能团环氧单体(cho):21%
[0104]
双官能团氧杂环丁烷单体(dox):76%
[0105]
碘鎓盐(iod):2%
[0106]
光敏剂(实施例1、2、3提供(i)-1~24):1%
[0107]
将上述配制实施例混合物涂覆于卡纸板上形成约30-35微米的涂层,以和光同盛公司生产的发射波长为405纳米的led光源(3厘米宽和80厘米长led 面光源)为激发光源,
功率为64mw/cm2,放置于变速传送带。以指甲反复压刻刮擦不产生印迹为光聚合固化完成的判据。
[0108]
结果表明含有本实施例的化合物均以高于30米/分钟的速度高效固化。
[0109]
对上述实施例化合物引发膜层完全固化,特别是(i)-4、(i)-15、(i)-16显示了更优秀引发性能,固化速度可提高到40米/分钟。
[0110]
实施例5:led光固化实验以及迁移性测试
[0111]
配制含环氧基团样品的感光性树脂体系
[0112]
按照表1中的具体比例(以重量百分比计),配制如下配方1~3,以及对比配方。
[0113]
表1光固化体系配方
[0114] 配方1配方2配方3对比配方epox96%96%96%96%双芳基碘鎓盐2%2%2%2%实施例2的i-42%
ꢀꢀꢀ
实施例3的i-15 2%
ꢀꢀ
实施例3的i-16
ꢀꢀ
2% 异丙基硫杂蒽酮itx
ꢀꢀꢀ
2%
[0115]
将上述配方分别注入30mm
×
4mm
×
1mm的硅胶垫模具中,在uv固化箱中固化2min,光强65mw/cm2。然后将样条粉碎,各取0.1g,用15ml乙腈在室温条件下萃取3天。最后,取相同量的萃取液进行紫外吸收测试。由式(1)及(2) 可得配方1,2,3相对于对比配方的相对迁移率。
[0116]
c=a/(ε
×
b)
ꢀꢀꢀꢀ
式(1)
[0117]
r=c
i-n
/c
itx
×
100%
ꢀꢀꢀꢀ
式(2)
[0118]
其中c为萃取液中引发剂的浓度(mol
·
l-1
);a为吸光度;ε为摩尔消光系数(l
·
mol-1
·
cm-1
);b为样品池厚度(cm);c
i-n
为萃取液中实施例提供的i-n的浓度(n=1/8/20);c
itx
为萃取液中itx的浓度;r为大分子引发剂的相对迁移率。
[0119]
测试结果如表2中表示:
[0120]
表2迁移率测试评价结果
[0121] 配方1配方2配方3对比配方迁移率8139100
[0122]
在同等条件下,合成物的迁移率仅为对比例的8-13%,大大降低了固化膜中中可以被萃取出来的敏化剂的含量,这说明本发明所制备的可阳离子引发聚合的光敏剂可以有效的降低引发剂的迁移,有希望进一步降低其可能带来的毒性、气味等问题。
[0123]
实施例6:led光激发光漂白实验
[0124]
取10微升实施例5中的配方1均匀涂覆在10mm
×
10mm的石英片上,配方的光谱变化由maya 2000光纤光谱仪测量。使用405nm led光源激发不同时间,在光谱仪上记录下测试不同时间的吸光度。具体结果如图1所示,可以发现配方在可见光区即400nm以上的吸光度几乎降为0,配方的颜色也从浅黄色变为无色,且涂覆的膜已固化。以指甲反复压刻刮擦不产生印迹为光聚合固化完成的判据。
[0125]
上述对实施例的描述是为了便于该技术领域的普通技术人员能理解和使用本发
明。熟悉本领域技术人员显然可以容易的对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中,而不必经过创造性的劳动。因此,本发明不限于上述实施例。本领域技术人员根据本发明的原理,不脱离本发明的范畴所做出的改进和修改都应该在本发明的保护范围之内。
