一种tmtp1多肽配体放射性探针及其制备方法和应用
技术领域
1.本发明属于多肽合成领域,具体涉及一种tmtp1多肽配体放射性探针及其制备方法和应用。
背景技术:
2.肝细胞癌(hepatocellular carcinoma,hcc)简称肝癌,是一种与慢性肝炎病毒感染密切相关的恶性肿瘤。肝癌复发转移的防治仍是临床未解决的难题,肝癌切除术、肝移植和局部消融治疗,是目前指南推荐的肝癌根治方法,是肝癌患者获得长期生存最重要的手段。但遗憾的是,患者术后5年肝癌复发转移率高达40-70%。因此,科学的确定肝癌高危人群、制定分层的监测方案,是早发现、早诊断和提高肝癌总体生存率最关键的环节3。
3.虽然肿瘤发生与转移的明确机制目前仍然不清楚,但是如果能在早期对癌症进行诊断,并确定肿瘤的恶性程度与转移能力,然后制定相应的手术、放疗或者化疗方案,就可以提高患者的存活率,并改善患者的生存质量。目前用于癌症诊断的成像方法主要有x
‑ꢀ
射线(ct),超声(us),核磁共振成像(mri)以及核医学spect/pet。ct、us和 mri是基于实体瘤的解剖结构分析,故他们无法在分子水平上检测肿瘤组织的生理变化,不能确定肿瘤的恶性程度,另外,它们对于高发性肿瘤(例如乳腺癌、肝癌、前列腺癌等) 的特异性和灵敏性较差,因此亟需开发一种新型可以特异性鉴别肿瘤恶性程度的放射性示踪剂,能够实现对恶性肿瘤的早期诊断,而且可以检测肿瘤的生长以及肿瘤对治疗方案的反应。
技术实现要素:
4.本发明的目的在于克服现有技术缺陷,提供一种tmtp1多肽配体放射性探针及其制备方法和应用。
5.本发明的另一目的在于提供上述tmtp1多肽配体放射性探针的制备方法。
6.本发明的再一目的在于提供上述tmtp1多肽配体放射性探针的应用。
7.本发明的又一目的在于提供一种高转移性肿瘤诊断治疗试剂盒。
8.本发明的技术方案如下:
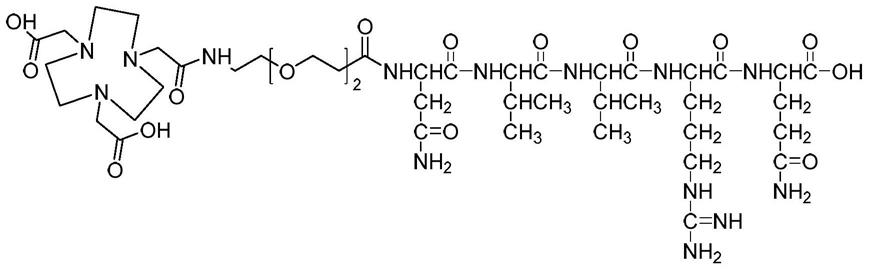
9.一种tmtp1多肽配体放射性探针,其结构式为其标记有放射性核素。
10.在本发明的一个优选实施方案中,所述放射性核素包括68ga、18f、64cu和177lu。
40mci)。混合物摇匀后在100℃反应10min,冷却至常温,用hplc 测定其标记率。
53.(4)纯化制得68ga-nota-peg2-tmtp1:将步骤(4)所得的物料缓慢注入事先活化过的sep-pak c18柱,再用20ml蒸馏水淋洗除去水溶性杂质,吹干后用800μl的乙醇淋洗,淋洗液用生理盐水稀释至乙醇含量小于10%,用hplc测定其保留时间和放化纯,观察其外观性状是否为无色澄清透明液体。经衰变校正的放化产率约90-98%,放化纯度>95%(图1)。
54.(5)荷smmc-7721肿瘤裸鼠micropet显像:smmc-7721荷瘤裸鼠麻醉状态下经尾静脉分别注射0.1ml 68ga-nota-peg2-tmtp1(7.4mbq)并于注射后40min进行静态 micropet/ct断层扫描(siemens inveon),图像采集后通过三维有序子集最大期望值法 three-dimensional ordered subset expectation maximization(3d opmap)algorithm进行空间重构。在衰变校正的冠状面显像图中,圈出肿瘤、正常组织和器官的感兴趣区域(regionof interest,roi),计算肿瘤模型中肿瘤/非肿瘤(t/nt)的放射性比值,肿瘤/肝脏=2.31
±
0.17,肿瘤/肌肉=2.91
±
0.54,其肿瘤摄取绝对值与靶与非靶比都比未经修饰的 68ga-nota-tmtp1高(请见对比例4),另外,其本底清除速率快,肝脏摄取低,具有优异的体内药动学性质(如图2所示)。
55.对比例1
56.(1)制备nota-peg8-tmtp1
57.将30mg多肽peg8-tmtp1(定制于美国多肽公司)溶于1ml dmf(二甲基甲酰胺) 中,加入50mg 1,4-二乙酸-1,4,7-三氮杂环壬烷-7-乙酸-n-羟基琥柏酰亚胺酯(nota-nhs ester,购买于chematech公司),然后加入diea(n,n-二异丙基乙胺)将ph调节到8.5,室温搅拌过夜,经hplc分离纯化,收集目标产物的馏分,合并后冻干,得目标产物 nota-peg8-tmtp1,经过hplc-质谱分析确认,参数同实施例1。ms,m/z:1323.9([m+h] +
)
[0058]
(2)制备
68
ga盐酸淋洗液:用4ml0.05m的盐酸淋洗ge-68/ga-68发生器,68ga 的盐酸淋洗液。
[0059]
(3)制备68ga-nota-peg8-tmtp1:向10ml的青霉素瓶中加入25μgnota-peg2-tmtp1,然后加入1ml 0.25m醋酸钠缓冲液溶解,然后再加入4ml 68ga 的盐酸淋洗液(20-40mci)。混合物摇匀后在100℃反应10min,冷却至常温,用hplc 测定其标记率。
[0060]
(4)纯化制得68ga-nota-peg8-tmtp1:将步骤(4)所得的物料缓慢注入事先活化过的sep-pak c18柱,再用20ml蒸馏水淋洗除去水溶性杂质,吹干后用800μl的乙醇淋洗,淋洗液用生理盐水稀释至乙醇含量小于10%,用hplc测定其保留时间和放化纯,观察其外观性状是否为无色澄清透明液体。经衰变校正的放化产率约80-98%,放化纯度>95%(图3)。
[0061]
(5)荷smmc-7721肿瘤裸鼠micropet显像:smmc-7721荷瘤裸鼠麻醉状态下经尾静脉分别注射0.1ml 68ga-nota-peg8-tmtp1(7.4mbq)并于注射后40min进行静态 micropet/ct断层扫描(siemens inveon),图像采集后通过三维有序子集最大期望值法 three-dimensional ordered subset expectation maximization(3d opmap)algorithm进行空间重构。在衰变校正的冠状面显像图中,圈出肿瘤、正常组织和器官的感兴趣区域(regionof interest,roi),计算肿瘤模型中肿瘤/非肿瘤(t/nt)的放射性比值,肿瘤/肝脏=1.50
±
0.24,肿瘤/肌肉=2.68
±
0.04,比68ga-nota-peg2-tmtp1性质差一些(如图4所示)。
[0062]
对比例2
[0063]
(1)制备nota-peg12-tmtp1
[0064]
将30mg多肽peg12-tmtp1(定制于美国多肽公司)溶于1ml dmf(二甲基甲酰胺) 中,加入50mg 1,4-二乙酸-1,4,7-三氮杂环壬烷-7-乙酸-n-羟基琥柏酰亚胺酯(nota-nhs ester,购买于chematech公司),然后加入diea(n,n-二异丙基乙胺)将ph调节到8.5,室温搅拌过夜,经hplc分离纯化,收集目标产物的馏分,合并后冻干,得目标产物 nota-peg12-tmtp1,经过hplc-质谱分析确认,参数同实施例1。ms,m/z:1500.3 ([m+h]
+
)
[0065]
(2)制备
68
ga盐酸淋洗液:用4ml0.05m的盐酸淋洗ge-68/ga-68发生器,68ga 的盐酸淋洗液。
[0066]
(3)制备68ga-nota-peg8-tmtp1:向10ml的青霉素瓶中加入25μgnota-peg12-tmtp1,然后加入1ml 0.25m醋酸钠缓冲液溶解,然后再加入4ml 68ga 的盐酸淋洗液(20-40mci)。混合物摇匀后在100℃反应10min,冷却至常温,用hplc 测定其标记率。
[0067]
(4)纯化制得68ga-nota-peg12-tmtp1:将步骤(4)所得的物料缓慢注入事先活化过的sep-pak c18柱,再用20ml蒸馏水淋洗除去水溶性杂质,吹干后用800μl的乙醇淋洗,淋洗液用生理盐水稀释至乙醇含量小于10%,用hplc测定其保留时间和放化纯,观察其外观性状是否为无色澄清透明液体。经衰变校正的放化产率约80-98%,放化纯度>95%(图5)。
[0068]
(5)荷smmc-7721肿瘤裸鼠micropet显像:smmc-7721荷瘤裸鼠麻醉状态下经尾静脉分别注射0.1ml 68ga-nota-peg12-tmtp1(7.4mbq)并于注射后40min进行静态 micropet/ct断层扫描(siemens inveon),图像采集后通过三维有序子集最大期望值法 three-dimensional ordered subset expectation maximization(3d opmap)algorithm进行空间重构。在衰变校正的冠状面显像图中,圈出肿瘤、正常组织和器官的感兴趣区域(regionof interest,roi),计算肿瘤模型中肿瘤/非肿瘤(t/nt)的放射性比值,肿瘤/肝脏=1.32
±
0.09,肿瘤/肌肉=2.41
±
0.42,比68ga-nota-peg2-tmtp1性质差一些(如图6所示)。
[0069]
对比例3
[0070]
(1)制备nota-peg24-tmtp1
[0071]
将30mg多肽peg24-tmtp1(定制于美国多肽公司)溶于1ml dmf(二甲基甲酰胺) 中,加入50mg 1,4-二乙酸-1,4,7-三氮杂环壬烷-7-乙酸-n-羟基琥柏酰亚胺酯(nota-nhs ester,购买于chematech公司),然后加入diea(n,n-二异丙基乙胺)将ph调节到8.5,室温搅拌过夜,经hplc分离纯化,收集目标产物的馏分,合并后冻干,得目标产物 nota-peg24-tmtp1,经过hplc-质谱分析确认,参数同实施例1。ms,m/z:1015.4 ([m+2h]
+
)
[0072]
(2)制备
68
ga盐酸淋洗液:用4ml0.05m的盐酸淋洗ge-68/ga-68发生器,68ga 的盐酸淋洗液。
[0073]
(3)制备68ga-nota-peg24-tmtp1:向10ml的青霉素瓶中加入25μgnota-peg24-tmtp1,然后加入1ml 0.25m醋酸钠缓冲液溶解,然后再加入4ml 68ga 的盐酸淋洗液(20-40mci)。混合物摇匀后在100℃反应10min,冷却至常温,用hplc 测定其标记率。
[0074]
(4)纯化制得68ga-nota-peg24-tmtp1:将步骤(4)所得的物料缓慢注入事先活化过的sep-pak c18柱,再用20ml蒸馏水淋洗除去水溶性杂质,吹干后用800μl的乙醇淋洗,淋洗液用生理盐水稀释至乙醇含量小于10%,用hplc测定其保留时间和放化纯,观察其外观性状是否为无色澄清透明液体。经衰变校正的放化产率约80-98%,放化纯度>98%(图7)。
[0075]
(5)荷smmc-7721肿瘤裸鼠micropet显像:smmc-7721荷瘤裸鼠麻醉状态下经尾静
脉分别注射0.1ml 68ga-nota-peg24-tmtp1(7.4mbq)并于注射后40min进行静态micropet/ct断层扫描(siemens inveon),图像采集后通过三维有序子集最大期望值法three-dimensional ordered subset expectation maximization(3d opmap)algorithm 进行空间重构。在衰变校正的冠状面显像图中,圈出肿瘤、正常组织和器官的感兴趣区域 (region of interest,roi),计算肿瘤模型中肿瘤/非肿瘤(t/nt)的放射性比值,肿瘤/ 肝脏=1.33
±
0.38,肿瘤/肌肉=2.71
±
0.28,比68ga-nota-peg2-tmtp1性质差一些(如图 8所示)。
[0076]
对比例4
[0077]
(1)制备nota-tmtp1
[0078]
将30mg多肽tmtp1(定制于美国多肽公司)溶于1ml dmf(二甲基甲酰胺)中,加入50mg 1,4-二乙酸-1,4,7-三氮杂环壬烷-7-乙酸-n-羟基琥柏酰亚胺酯(nota-nhs ester,购买于chematech公司),然后加入diea(n,n-二异丙基乙胺)将ph调节到8.5,室温搅拌过夜,经hplc分离纯化,收集目标产物的馏分,合并后冻干,得目标产物 nota-tmtp1,经过hplc-质谱分析确认,参数同实施例1。ms,m/z:957.8([m+h]
+
)
[0079]
(2)制备
68
ga盐酸淋洗液:用4ml0.05m的盐酸淋洗ge-68/ga-68发生器,68ga 的盐酸淋洗液。
[0080]
(3)制备68ga-nota-tmtp1:向10ml的青霉素瓶中加入25μg nota-tmtp1,然后加入1ml 0.25m醋酸钠缓冲液溶解,然后再加入4ml 68ga的盐酸淋洗液(20-40 mci)。混合物摇匀后在100℃反应10min,冷却至常温,用hplc测定其标记率。
[0081]
(4)纯化制得68ga-nota-tmtp1:将步骤(4)所得的物料缓慢注入事先活化过的sep-pak c18柱,再用20ml蒸馏水淋洗除去水溶性杂质,吹干后用800μl的乙醇淋洗,淋洗液用生理盐水稀释至乙醇含量小于10%,用hplc测定其保留时间和放化纯,观察其外观性状是否为无色澄清透明液体。经衰变校正的放化产率约80-98%,放化纯度>98%(图9)。
[0082]
(5)荷smmc-7721肿瘤裸鼠micropet显像:smmc-7721荷瘤裸鼠麻醉状态下经尾静脉分别注射0.1ml 68ga-nota-tmtp1(7.4mbq)并于注射后40min进行静态 micropet/ct断层扫描(siemens inveon),图像采集后通过三维有序子集最大期望值法 three-dimensional ordered subset expectation maximization(3d opmap)algorithm进行空间重构。在衰变校正的冠状面显像图中,圈出肿瘤、正常组织和器官的感兴趣区域(regionof interest,roi),计算肿瘤模型中肿瘤/非肿瘤(t/nt)的放射性比值,肿瘤/肝脏=1.13
±
0.29,肿瘤/肌肉=2.25
±
0.08,比实施例1中的68ga-nota-peg2-tmtp1性质差一些(如图10所示)。
[0083]
以上所述,仅为本发明的较佳实施例而已,故不能依此限定本发明实施的范围,即依本发明专利范围及说明书内容所作的等效变化与修饰,皆应仍属本发明涵盖的范围内。
