1.本公开涉及一种有机电致发光化合物、包含特定化合物的组合的主体材料以及一种包含其的有机电致发光装置。
背景技术:
2.1987年,伊士曼柯达公司(eastman kodak)的tang等人首次开发了由发光层和电荷传输层组成的tpd/alq3双层的小分子绿色有机电致发光装置(oled)。此后,oled的发展迅速受到影响并且oled已经被商业化。当前,有机电致发光装置主要使用在实现面板方面具有优异的发光效率的磷光体。对于长时间使用和高分辨率的显示器而言,需要具有高发光效率和/或长寿命的oled。
3.为了改善发光效率、驱动电压和/或寿命,已经提出了用于有机电致发光装置的有机层的各种材料或观念,但是它们在实际使用中并不令人满意。因此,持续需要开发一种与先前已知的有机电致发光装置相比具有改善的性能,例如改善的驱动电压、发光效率、功率效率和/或寿命特性的有机电致发光装置。
4.韩国专利号10-1577104公开了稠合二氢菲衍生物,但未能具体地公开含有取代的二氢菲的化合物。仍然需要开发一种用于改善oled性能的有机电致发光材料。
技术实现要素:
5.技术问题
6.本公开的目的是提供一种有机电致发光化合物,其具有适于将其应用于有机电致发光装置的新颖结构。本公开的另一个目的是提供一种改善的有机电致发光材料,其能够提供具有降低的驱动电压、改善的发光效率和/或长寿命特性的有机电致发光装置。本公开的另一个目的是通过包含化合物的特定组合作为主体材料来提供一种具有改善的驱动电压、发光效率和/或寿命特性的有机电致发光装置。
7.问题的解决方案
8.本发明的诸位发明人通过发现由下式1表示的化合物实现上述目的已经完成了本公开。本公开的由式1表示的化合物可以与由式2、式3或式4表示的化合物组合来作为多种主体材料应用于有机电致发光装置。
9.10.在式1中,
11.r
11
至r
14
各自独立地表示氢、氘、取代或未取代的(c1-c30)烷基、取代或未取代的(c6-c30)芳基、或取代或未取代的(3元至30元)杂芳基,或者可以与相邻取代基连接形成环,前提是r
11
至r
14
中的至少一个不是氢也不是氘;
12.r1至r8各自独立地表示氢、氘或-l-ar,或者可以与相邻取代基连接形成环,前提是r1和r2、r2和r3、r3和r4、r5和r6、r6和r7以及r7和r8中的至少一对彼此连接以稠合为下式a:
[0013][0014]
其中
[0015]
x表示nr
31
、o、s、cr
32r33
或-cr
34
=cr
35-;
[0016]r31
表示-l
1-ar1;
[0017]r32
和r
33
各自独立地表示取代或未取代的(c1-c30)烷基、取代或未取代的(c6-c30)芳基、或取代或未取代的(3元至30元)杂芳基,或者可以与相邻取代基连接形成环;
[0018]r34
和r
35
各自独立地表示氢、氘或-l
5-ar5;
[0019]r21
至r
24
各自独立地表示氢、氘或-l
2-ar2,或者可以与相邻取代基连接形成环;
[0020]
l、l1、l2和l5各自独立地表示单键、取代或未取代的(c1-c30)亚烷基、取代或未取代的(c6-c30)亚芳基、取代或未取代的(3元至30元)亚杂芳基、或取代或未取代的(c3-c30)亚环烷基;
[0021]
ar、ar1、ar2和ar5各自独立地表示卤素、氰基、取代或未取代的(c1-c30)烷基、取代或未取代的(c6-c30)芳基、取代或未取代的(3元至30元)杂芳基、取代或未取代的(c3-c30)环烷基、或取代或未取代的(c1-c30)烷氧基,或者由下式b或c表示:
[0022][0023]
其中
[0024]ral
、r
a2
、r
b1
、r
b2
和r
b3
各自独立地表示取代或未取代的(c6-c30)芳基、取代或未取代的(3元至30元)杂芳基、或取代或未取代的(c3-c30)环烷基;
[0025]
在式a中表示与r1至r8的结合位点;并且
[0026]
在式b和式c中分别表示与l、l1、l2或l5的结合位点。
[0027][0028]
在式2中,
[0029]
x1和y1各自独立地表示-n=、-nr
67-、-o-或-s-,前提是x1和y1中的任一个表示-n=,并且x1和y1中的另一个表示-nr
67-、-o-或-s-;
[0030]r61
表示取代或未取代的(c6-c30)芳基或取代或未取代的(3元至30元)杂芳基;
[0031]r62
至r
64
和r
67
各自独立地表示氢、氘、卤素、氰基、取代或未取代的(c1-c30)烷基、取代或未取代的(c6-c30)芳基、取代或未取代的(3元至30元)杂芳基、取代或未取代的(c3-c30)环烷基、取代或未取代的(c1-c30)烷氧基、取代或未取代的三(c1-c30)烷基甲硅烷基、取代或未取代的二(c1-c30)烷基(c6-c30)芳基甲硅烷基、取代或未取代的(c1-c30)烷基二(c6-c30)芳基甲硅烷基、取代或未取代的三(c6-c30)芳基甲硅烷基、一个或多个(c3-c30)脂肪族环和一个或多个(c6-c30)芳香族环的取代或未取代的稠环、或-l3″‑
n(ar3″
)(ar4″
);或者可以与相邻取代基连接形成环;
[0032]
l3″
各自独立地表示单键、取代或未取代的(c6-c30)亚芳基、或取代或未取代的(3元至30元)亚杂芳基;
[0033]
ar3″
和ar4″
各自独立地表示氢、取代或未取代的(c1-c30)烷基、取代或未取代的(c2-c30)烯基、一个或多个(c3-c30)脂肪族环和一个或多个(c6-c30)芳香族环的取代或未取代的稠环、取代或未取代的(c6-c30)芳基、或取代或未取代的(3元至30元)杂芳基;
[0034]r65
和r
66
各自独立地表示取代或未取代的(c6-c30)芳基或取代或未取代的(3元至30元)杂芳基;
[0035]
l4表示单键、取代或未取代的(c6-c30)亚芳基、或取代或未取代的(3元至30元)亚杂芳基;并且
[0036]
a表示1,b和c各自独立地表示1或2,d表示1至4的整数,并且当b至d是2或更大的整数时,每个r
62
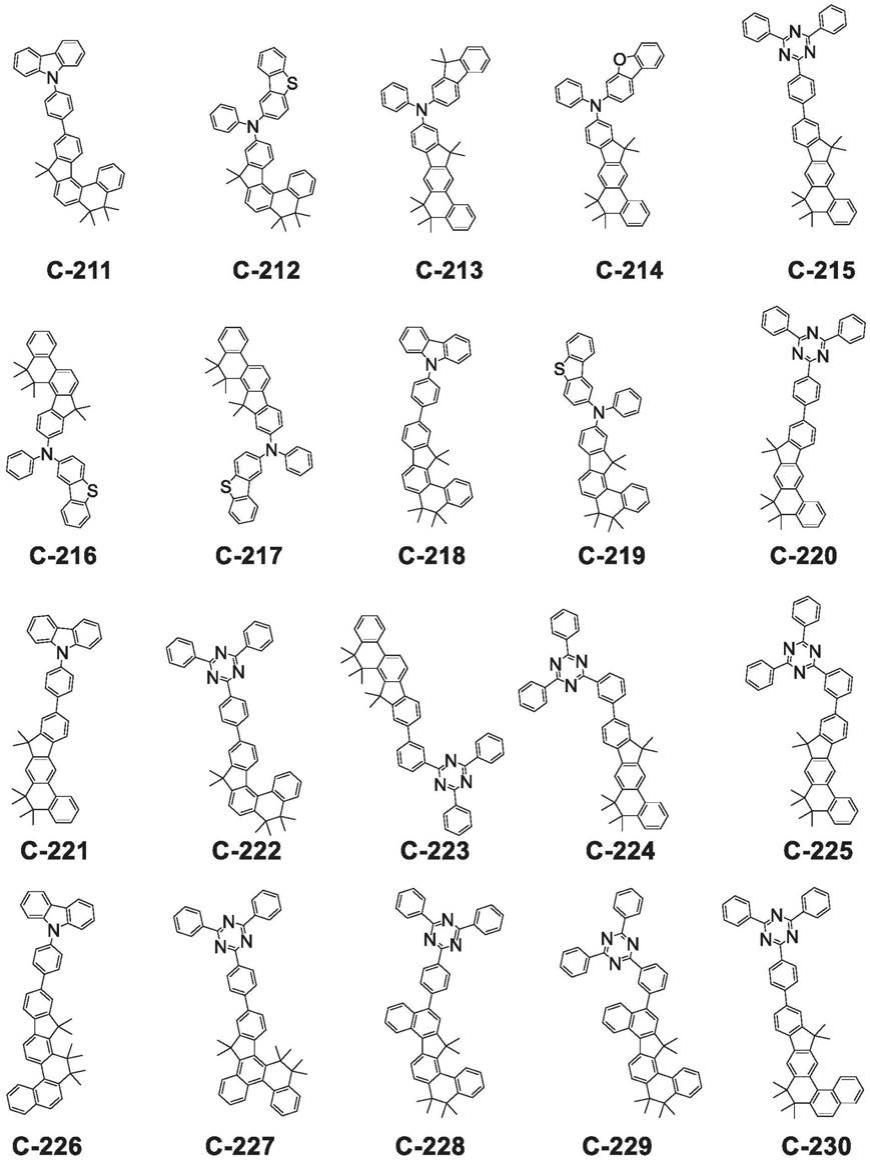
至每个r
64
可以彼此相同或不同。
[0037][0038]
在式3中,
[0039]
la和lb各自独立地表示单键、取代或未取代的(c6-c30)亚芳基、或取代或未取代的(3元至30元)亚杂芳基;
[0040]
ara和arb各自独立地表示取代或未取代的(c1-c30)烷基、取代或未取代的(c6-c30)芳基、或取代或未取代的(3元至30元)杂芳基;
[0041]r301
至r
304
各自独立地表示氢、氘、卤素、氰基、取代或未取代的(c1-c30)烷基、取代或未取代的(c6-c30)芳基、取代或未取代的(3元至30元)杂芳基、取代或未取代的(c3-c30)环烷基、取代或未取代的(c1-c30)烷氧基、取代或未取代的三(c1-c30)烷基甲硅烷基、取代或未取代的二(c1-c30)烷基(c6-c30)芳基甲硅烷基、取代或未取代的(c1-c30)烷基二(c6-c30)芳基甲硅烷基、取代或未取代的三(c6-c30)芳基甲硅烷基、一个或多个(c3-c30)脂肪族环和一个或多个(c6-c30)芳香族环的取代或未取代的稠环、或-l3″′‑
n(ar3″′
)(ar4″′
);或者可以与相邻取代基连接形成环;
[0042]
l3″′
各自独立地表示单键、取代或未取代的(c6-c30)亚芳基、或取代或未取代的(3元至30元)亚杂芳基;
[0043]
ar3″′
和ar4″′
各自独立地表示氢、取代或未取代的(c1-c30)烷基、取代或未取代的(c2-c30)烯基、一个或多个(c3-c30)脂肪族环和一个或多个(c6-c30)芳香族环的取代或未取代的稠环、取代或未取代的(c6-c30)芳基、或取代或未取代的(3元至30元)杂芳基;并且
[0044]
f和i各自独立地表示1至4的整数,g和h各自独立地表示1至3的整数,并且当f至i是2或更大的整数时,每个r
301
至每个r
304
可以彼此相同或不同。
[0045][0046]
在式4中,
[0047]
t表示-o-或-s-;
[0048]
har表示取代或未取代的含氮(3元至30元)杂芳基;
[0049]
l
51
表示单键、取代或未取代的(c6-c30)亚芳基、或取代或未取代的(3元至30元)亚杂芳基;
[0050]r71
和r
72
各自独立地表示氢、氘、卤素、氰基、取代或未取代的(c1-c30)烷基、取代或未取代的(c6-c30)芳基、取代或未取代的(3元至30元)杂芳基、取代或未取代的(c3-c30)环烷基、取代或未取代的(c1-c30)烷氧基、取代或未取代的三(c1-c30)烷基甲硅烷基、取代或未取代的二(c1-c30)烷基(c6-c30)芳基甲硅烷基、取代或未取代的(c1-c30)烷基二(c6-c30)芳基甲硅烷基、取代或未取代的三(c6-c30)芳基甲硅烷基、取代或未取代的单-或二-(c1-c30)烷基氨基、取代或未取代的单-或二-(c6-c30)芳基氨基、或取代或未取代的(c1-c30)烷基(c6-c30)芳基氨基,或者可以与相邻取代基连接形成环;并且
[0051]a11
表示1至4的整数,b
12
表示1至3的整数,并且当a
11
和b
12
各自表示2或更大的整数时,每个r
71
和每个r
72
可以彼此相同或不同。
[0052]
本发明的有益效果
[0053]
根据本公开的有机电致发光化合物展现出适于将其用于有机电致发光装置的性能。此外,通过包含根据本公开的化合物的特定组合作为主体材料,提供了一种与常规有机电致发光装置相比具有较低的驱动电压、较高的发光效率和/或较长的寿命特性的有机电致发光装置。例如,通过包含本公开的化合物,可以提供具有低驱动电压、高发光效率和/或长寿命特性的发红光的有机电致发光装置。
具体实施方式
[0054]
在下文中,将详细描述本公开。然而,以下描述旨在解释本发明,并不意味着限制本发明的范围。
[0055]
本公开中的术语“有机电致发光化合物”意指可以用于有机电致发光装置中并且如有需要可以包含在构成有机电致发光装置的任何层中的化合物。
[0056]
本公开中的术语“有机电致发光材料”意指可以用于有机电致发光装置中并且可以包含至少一种化合物的材料。如有需要,有机电致发光材料可以包含在构成有机电致发光装置的任何层中。例如,有机电致发光材料可以是空穴注入材料、空穴传输材料、空穴辅助材料、发光辅助材料、电子阻挡材料、发光材料(包含主体材料和掺杂剂材料)、电子缓冲材料、空穴阻挡材料、电子传输材料、或电子注入材料。
[0057]
本公开中的术语“多种有机电致发光材料”意指一种或多种包含至少两种化合物的组合的有机电致发光材料,其可以包含在构成有机电致发光装置的任何有机层中。它可以意指包含在有机电致发光装置中之前(例如,在气相沉积之前)的材料和包含在有机电致发光装置中之后(例如,在气相沉积之后)的材料两者。例如,多种有机电致发光材料可以是可以包含在以下中的至少一个层中的两种或更多种化合物的组合:空穴注入层、空穴传输层、空穴辅助层、发光辅助层、电子阻挡层、发光层、电子缓冲层、空穴阻挡层、电子传输层、和电子注入层。此类两种或更多种化合物可以通过本领域中使用的方法包含在同一层或不同层中,并且可以是混合蒸发或共蒸发的,或者单个地沉积的。
[0058]
本公开中的术语“多种主体材料”意指一种或多种包含至少两种化合物的组合的主体材料,其可以包含在构成有机电致发光装置的任何发光层中。它可以意指包含在有机电致发光装置中之前(例如,在气相沉积之前)的材料和包含在有机电致发光装置中之后(例如,在气相沉积之后)的材料两者。例如,本公开的多种主体材料可以是两种或更多种主体材料的组合,并且可以任选地进一步包括包含在有机电致发光材料中的常规材料。包含
在本公开的多种主体材料中的两种或更多种主体材料可以包含在一个发光层中,或者可以分别包含在不同的发光层中。例如,两种或更多种主体材料可以是混合蒸发或共蒸发的,或者单个地沉积的。
[0059]
本公开的有机电致发光材料可以包含一种或多种类型的由式1表示的化合物。具有式1的化合物可以包含在空穴注入层、空穴传输层、空穴辅助层、发光辅助层、电子阻挡层、发光层、电子缓冲层、空穴阻挡层、电子传输层和/或电子注入层等中,但不限于此。具有式1的化合物可以包含在发光层中,但不限于此。当具有式1的化合物包含在发光层中时,其可以作为主体材料被包含。在此,主体材料可以是发射蓝光、绿光或红光的有机电致发光装置的主体材料。
[0060]
在下文中,将更详细地描述由式1表示的化合物。
[0061]
在本文中,术语“(c1-c30)(亚)烷基”意指具有1至30个构成链的碳原子的直链或支链(亚)烷基,其中碳原子的数目优选地是1至20,并且更优选地是1至10。上述烷基可以包括甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、仲丁基等。术语“(c2-c30)烯基”意指具有2至30个构成链的碳原子的直链或支链烯基,其中碳原子的数目优选地是2至20,并且更优选地是2至10。上述烯基可以包括乙烯基、1-丙烯基、2-丙烯基、1-丁烯基、2-丁烯基、3-丁烯基、2-甲基丁-2-烯基等。术语“(c2-c30)炔基”意指具有2至30个构成链的碳原子的直链或支链炔基,其中碳原子的数目优选地是2至20,并且更优选地是2至10。上述炔基可以包括乙炔基、1-丙炔基、2-丙炔基、1-丁炔基、2-丁炔基、3-丁炔基、1-甲基戊-2-炔基等。术语“(c3-c30)(亚)环烷基”意指具有3至30个环主链碳原子的单环烃或多环烃,其中碳原子的数目优选地是3至20,并且更优选地是3至7。上述环烷基可以包括环丙基、环丁基、环戊基、环己基、环戊基甲基、环己基甲基等。术语“(3元至7元)杂环烷基”意指具有3至7个、优选5至7个环骨架原子并且包括至少一个杂原子的环烷基,该杂原子选自由b、n、o、s、si和p组成的组、优选地选自由o、s和n组成的组。上述杂环烷基可以包括四氢呋喃、吡咯烷、四氢噻吩(thiolane)、四氢吡喃等。术语“(c6-c30)(亚)芳基”意指衍生自具有6至30个环骨架碳原子的芳香族烃的单环或稠环基团,其可以是部分饱和的。环骨架碳原子的数目优选地是6至25、并且更优选地是6至18。上述芳基包括具有螺结构的那些。上述芳基可以包括苯基、联苯基、三联苯基、萘基、联萘基、苯基萘基、萘基苯基、苯基三联苯基、芴基、苯基芴基、二苯基芴基、苯并芴基、二苯并芴基、菲基、苯基菲基、蒽基、茚基、三亚苯基、芘基、并四苯基、苝基、基、萘并萘基、荧蒽基、螺二芴基、薁基、四甲基二氢菲基等。更具体地,芳基可以包括苯基、1-萘基、2-萘基、1-蒽基、2-蒽基、9-蒽基、苯并蒽基、1-菲基、2-菲基、3-菲基、4-菲基、9-菲基、萘并萘基、芘基、1-基、2-基、3-基、4-基、5-基、6-基、苯并[c]菲基、苯并[g]基、1-三亚苯基、2-三亚苯基、3-三亚苯基、4-三亚苯基、1-芴基、2-芴基、3-芴基、4-芴基、9-芴基、苯并[a]芴基、苯并[b]芴基、苯并[c]芴基、二苯并芴基、2-联苯基、3-联苯基、4-联苯基、邻三联苯基、间三联苯基-4-基、间三联苯基-3-基、间三联苯基-2-基、对三联苯基-4-基、对三联苯基-3-基、对三联苯基-2-基、间四联苯基、3-荧蒽基、4-荧蒽基、8-荧蒽基、9-荧蒽基、苯并荧蒽基、邻甲苯基、间甲苯基、对甲苯基、2,3-二甲苯基、3,4-二甲苯基、2,5-二甲苯基、均三甲苯基、邻枯烯基、间枯烯基、对枯烯基、对叔丁基苯基、对-(2-苯基丙基)苯基、4
′‑
甲基联苯基、4
″‑
叔丁基-对三联苯基-4-基、9,9-二甲基-1-芴基、9,9-二甲基-2-芴基、9,9-二甲基-3-芴基、9,9-二甲基-4-芴基、9,9-二苯基-1-芴基、9,9-二苯基-2-芴基、9,
9-二苯基-3-芴基、9,9-二苯基-4-芴基、11,11-二甲基-1-苯并[a]芴基、11,11-二甲基-2-苯并[a]芴基、11,11-二甲基-3-苯并[a]芴基、11,11-二甲基-4-苯并[a]芴基、11,11-二甲基-5-苯并[a]芴基、11,11-二甲基-6-苯并[a]芴基、11,11-二甲基-7-苯并[a]芴基、11,11-二甲基-8-苯并[a]芴基、11,11-二甲基-9-苯并[a]芴基、11,11-二甲基-10-苯并[a]芴基、11,11-二甲基-1-苯并[b]芴基、11,11-二甲基-2-苯并[b]芴基、11,11-二甲基-3-苯并[b]芴基、11,11-二甲基-4-苯并[b]芴基、11,11-二甲基-5-苯并[b]芴基、11,11-二甲基-6-苯并[b]芴基、11,11-二甲基-7-苯并[b]芴基、11,11-二甲基-8-苯并[b]芴基、11,11-二甲基-9-苯并[b]芴基、11,11-二甲基-10-苯并[b]芴基、11,11-二甲基-1-苯并[c]芴基、11,11-二甲基-2-苯并[c]芴基、11,11-二甲基-3-苯并[c]芴基、11,11-二甲基-4-苯并[c]芴基、11,11-二甲基-5-苯并[c]芴基、11,11-二甲基-6-苯并[c]芴基、11,11-二甲基-7-苯并[c]芴基、11,11-二甲基-8-苯并[c]芴基、11,11-二甲基-9-苯并[c]芴基、11,11-二甲基-10-苯并[c]芴基、11,11-二苯基-1-苯并[a]芴基、11,11-二苯基-2-苯并[a]芴基、11,11-二苯基-3-苯并[a]芴基、11,11-二苯基-4-苯并[a]芴基、11,11-二苯基-5-苯并[a]芴基、11,11-二苯基-6-苯并[a]芴基、11,11-二苯基-7-苯并[a]芴基、11,11-二苯基-8-苯并[a]芴基、11,11-二苯基-9-苯并[a]芴基、11,11-二苯基-10-苯并[a]芴基、11,11-二苯基-1-苯并[b]芴基、11,11-二苯基-2-苯并[b]芴基、11,11-二苯基-3-苯并[b]芴基、11,11-二苯基-4-苯并[b]芴基、11,11-二苯基-5-苯并[b]芴基、11,11-二苯基-6-苯并[b]芴基、11,11-二苯基-7-苯并[b]芴基、11,11-二苯基-8-苯并[b]芴基、11,11-二苯基-9-苯并[b]芴基、11,11-二苯基-10-苯并[b]芴基、11,11-二苯基-1-苯并[c]芴基、11,11-二苯基-2-苯并[c]芴基、11,11-二苯基-3-苯并[c]芴基、11,11-二苯基-4-苯并[c]芴基、11,11-二苯基-5-苯并[c]芴基、11,11-二苯基-6-苯并[c]芴基、11,11-二苯基-7-苯并[c]芴基、11,11-二苯基-8-苯并[c]芴基、11,11-二苯基-9-苯并[c]芴基、11,11-二苯基-10-苯并[c]芴基、9,9,10,10-四甲基-9,10-二氢-1-菲基、9,9,10,10-四甲基-9,10-二氢-2-菲基、9,9,10,10-四甲基-9,10-二氢-3-菲基、9,9,10,10-四甲基-9,10-二氢-4-菲基等。
[0062]
术语“(3元至30元)(亚)杂芳基”意指具有3至30个环骨架原子并且包含至少一个选自由b、n、o、s、si和p组成的组的杂原子的芳基或亚芳基。杂原子的数目优选地是1至4。上述(亚)杂芳基可以是单环或与至少一个苯环缩合的稠环,并且可以是部分饱和的。此外,上述(亚)杂芳基包括其中经由一个或多个单键将至少一个杂芳基或芳基与杂芳基连接的形式,并且还包括具有螺结构的那些。上述杂芳基可以包括单环型杂芳基,如呋喃基、噻吩基、吡咯基、咪唑基、吡唑基、噻唑基、噻二唑基、异噻唑基、异噁唑基、噁唑基、噁二唑基、三嗪基、四嗪基、三唑基、四唑基、呋咱基、吡啶基、吡嗪基、嘧啶基、哒嗪基等,和稠环型杂芳基,如苯并呋喃基、苯并噻吩基、异苯并呋喃基、二苯并呋喃基、二苯并噻吩基、二苯并硒吩基、萘并苯并呋喃基、萘并苯并噻吩基、苯并呋喃并喹啉基、苯并呋喃并喹唑啉基、苯并呋喃并萘啶基、苯并呋喃并嘧啶基、萘并呋喃并嘧啶基、苯并噻吩并喹啉基、苯并噻吩并喹唑啉基、苯并噻吩并萘啶基、苯并噻吩并嘧啶基、萘并噻吩并嘧啶基、嘧啶并吲哚基、苯并嘧啶并吲哚基、苯并呋喃并吡嗪基、萘并呋喃并吡嗪基、苯并噻吩并吡嗪基、萘并噻吩并吡嗪基、吡嗪并吲哚基、苯并吡嗪并吲哚基、苯并咪唑基、苯并噻唑基、苯并异噻唑基、苯并异噁唑基、苯并噁唑基、异吲哚基、吲哚基、苯并吲哚基、吲唑基、苯并噻二唑基、喹啉基、异喹啉基、噌啉基、喹唑啉基、苯并喹唑啉基、喹喔啉基、苯并喹喔啉基、萘啶基、咔唑基、苯并咔唑基、二苯
c30)烷基(c6-c30)芳基。根据本公开的一个实施例,取代基各自独立地是选自由以下组成的组的至少一个:一个或多个(c1-c6)烷基;一个或多个(5元至15元)杂芳基;未取代的或被至少一个(c1-c6)烷基取代的一个或多个(c6-c15)芳基。具体地,取代基各自独立地可以是甲基、苯基、萘基、联苯基、二甲基芴基、四甲基二氢菲基、吡啶基、二苯并噻吩基、二苯并呋喃基和咔唑基中的至少一个。
[0065]
在本公开的式中,如果取代基与相邻取代基连接形成环,则该环可以是取代或未取代的、单环或多环的(3元至30元)脂环族环或芳香族环、或由连接至少两个相邻取代基所形成的其组合。此外,所形成的环可以含有至少一个选自b、n、o、s、si和p的杂原子,优选地至少一个选自n、o和s的杂原子。根据本公开的一个实施例,环骨架原子的数目是5至20,并且根据本公开的另一个实施例,环骨架原子的数目是5至15。
[0066]
在本公开的式中,杂芳基、亚杂芳基和杂环烷基各自独立地可以含有至少一个选自b、n、o、s、si和p的杂原子。此外,杂原子可以与选自由以下组成的组的至少一个键合:氢、氘、卤素、氰基、取代或未取代的(c1-c30)烷基、取代或未取代的(c6-c30)芳基、取代或未取代的(5元至30元)杂芳基、取代或未取代的(c3-c30)环烷基、取代或未取代的(c1-c30)烷氧基、取代或未取代的三(c1-c30)烷基甲硅烷基、取代或未取代的二(c1-c30)烷基(c6-c30)芳基甲硅烷基、取代或未取代的(c1-c30)烷基二(c6-c30)芳基甲硅烷基、取代或未取代的三(c6-c30)芳基甲硅烷基、取代或未取代的单-或二-(c1-c30)烷基氨基、取代或未取代的单-或二-(c6-c30)芳基氨基、以及取代或未取代的(c1-c30)烷基(c6-c30)芳基氨基。
[0067]
在式1中,r
11
至r
14
各自独立地表示氢、氘、取代或未取代的(c1-c30)烷基、取代或未取代的(c6-c30)芳基、或取代或未取代的(3元至30元)杂芳基,或者可以与相邻取代基连接形成环,前提是r
11
至r
14
中的至少一个不是氢也不是氘。根据本公开的一个实施例,r
11
至r
14
各自独立地表示取代或未取代的(c1-c6)烷基。根据本公开的另一个实施例,r
11
至r
14
各自独立地表示未取代的(c1-c6)烷基。例如,所有r
11
至r
14
可以是甲基。
[0068]
在式1中,r1至r8各自独立地表示氢、氘或-l-ar,或者可以与相邻取代基连接形成环,前提是r1和r2、r2和r3、r3和r4、r5和r6、r6和r7以及r7和r8中的至少一对彼此连接以稠合为下式a:
[0069][0070]
其中x表示nr
31
、o、s、cr
32r33
或-cr
34
=cr
35-,并且r
31
表示-l
1-ar1。
[0071]
在本文中,r
32
和r
33
各自独立地表示取代或未取代的(c1-c30)烷基、取代或未取代的(c6-c30)芳基、或取代或未取代的(3元至30元)杂芳基,或者可以与相邻取代基连接形成环。根据本公开的一个实施例,r
32
和r
33
各自独立地表示取代或未取代的(c1-c6)烷基。根据本公开的另一个实施例,r
32
和r
33
各自独立地表示未取代的(c1-c6)烷基。例如,所有r
32
和r
33
可以是甲基。
[0072]r34
和r
35
各自独立地表示氢、氘或-l
5-ar5。根据本公开的一个实施例,r
34
和r
35
各自独立地表示氢或-l
5-ar5。例如,r
34
和r
35
各自独立地可以是氢、-l
5-ar5等。
[0073]
在式a中,r
21
至r
24
各自独立地表示氢、氘或-l
2-ar2,或者可以与相邻取代基连接形成环。根据本公开的一个实施例,r
21
至r
24
各自独立地表示氢或-l
2-ar2,或者可以与相邻取代基连接形成取代或未取代的芳香族环。根据本公开的另一个实施例,r
21
至r
24
各自独立地表示氢或-l
2-ar2,或者可以与相邻取代基连接形成未取代的芳香族环。例如,r
21
至r
24
各自独立地可以是氢或-l
2-ar2,或者可以与相邻取代基连接形成苯环。
[0074]
在式1和式a中,l、l1、l2和l5各自独立地表示单键、取代或未取代的(c1-c30)亚烷基、取代或未取代的(c6-c30)亚芳基、取代或未取代的(3元至30元)亚杂芳基、或取代或未取代的(c3-c30)亚环烷基。根据本公开的一个实施例,l、l1、l2和l5各自独立地表示单键、取代或未取代的(c6-c15)亚芳基、或取代或未取代的(5元至15元)亚杂芳基。根据本公开的另一个实施例,l、l1、l2和l5各自独立地表示单键、未取代的或被至少一个(c6-c12)芳基取代的(c6-c15)亚芳基、或未取代的(5元至15元)亚杂芳基。例如,l可以是单键、亚苯基、亚喹唑啉基、亚喹喔啉基等。l1可以是单键、亚苯基、亚萘基、亚联苯基、被苯基取代的亚苯基、亚吡啶基、亚喹唑啉基、亚喹喔啉基、亚咔唑基等,l2可以是单键、亚苯基、亚喹唑啉基、亚喹喔啉基、亚咔唑基等,并且l5可以是单键、亚喹唑啉基等。
[0075]
在式1和式a中,ar、ar1、ar2和ar5各自独立地表示卤素、氰基、取代或未取代的(c1-c30)烷基、取代或未取代的(c6-c30)芳基、取代或未取代的(3元至30元)杂芳基、取代或未取代的(c3-c30)环烷基、或取代或未取代的(c1-c30)烷氧基,或者由下式b或c表示:
[0076][0077]
其中r
a1
、r
a2
、r
b1
、r
b2
和r
b3
各自独立地表示取代或未取代的(c6-c30)芳基、取代或未取代的(3元至30元)杂芳基、或取代或未取代的(c3-c30)环烷基。
[0078]
根据本公开的一个实施例,ar、ar1、ar2和ar5各自独立地表示取代或未取代的(c6-c20)芳基或取代或未取代的(5元至15元)杂芳基,或者由式b表示。根据本公开的另一个实施例,ar、ar1、ar2和ars各自独立地表示未取代的或被至少一个(5元至15元)杂芳基取代的(c6-c20)芳基、或未取代的或被一个或多个(5元至15元)杂芳基中的至少一个取代的(5元至15元)杂芳基和未取代的或被一个或多个(c1-c6)烷基取代的一个或多个(c6-c15)芳基,或者由式b表示。例如,ar可以是苯基、被咔唑基取代的苯基、二苯基三嗪基、被苯基和二苯并呋喃基取代的三嗪基、被至少一个苯基取代的喹唑啉基、被至少一个苯基取代的喹喔啉基、咔唑基、二苯基氨基、萘基联苯基氨基、苯基二甲基芴基氨基、苯基二苯并呋喃基氨基、苯基二苯并噻吩基氨基等。ar1可以是苯基、联苯基、三联苯基、被咔唑基取代的苯基、二苯基三嗪基、被苯基和萘基取代的三嗪基、被苯基和联苯基取代的三嗪基、被苯基和二甲基芴基取代的三嗪基、被苯基和四甲基二氢菲基取代的三嗪基、被苯基和吡啶基取代的三嗪基、被苯基和二苯并呋喃基取代的三嗪基、被苯基和二苯并噻吩基取代的三嗪基、被至少一个苯基取代的喹唑啉基、被至少一个苯基取代的喹喔啉基、咔唑基、被苯基取代的咔唑基、二苯基氨基等。ar2可以是苯基、二苯基三嗪基、被苯基和二苯并呋喃基取代的三嗪基、被至少一个苯基取代的喹唑啉基、被至少一个苯基取代的喹喔啉基、咔唑基、被苯基取代的咔唑基、二苯基氨基、苯基联苯基氨基、苯基二甲基芴基氨基、苯基二苯并呋喃基氨基、苯基二苯
并噻吩基氨基等。ar5可以是联苯基、二苯基三嗪基、被苯基和萘基取代的三嗪基、被苯基和二苯并呋喃基取代的三嗪基、被苯基和四甲基二氢菲基取代的三嗪基、苯基二苯并呋喃基氨基、苯基二甲基芴基氨基等。
[0079]
在式a中,表示与r1至r8的结合位点。
[0080]
在式b和式c中,分别表示与l、l1、l2或l5的结合位点。
[0081]
根据本公开的一个实施例,式1可以由下式1-1至1-6中的至少一个表示:
[0082]
[0083][0084]
其中r1至r8、r
11
至r
14
、r
21
至r
24
、以及x是如式1中所定义的。
[0085]
根据本公开的一个实施例,式1可以由下式1-11至1-13中的至少一个表示:
[0086]
[0087][0088]
其中r1至r8和r
11
至r
14
是如式1中所定义的;
[0089]r41
至r
44
各自独立地表示氢、氘、卤素、氰基、取代或未取代的(c1-c30)烷基、取代或未取代的(c6-c30)芳基、取代或未取代的(3元至30元)杂芳基、取代或未取代的(c3-c30)环烷基、取代或未取代的(c1-c30)烷氧基、取代或未取代的三(c1-c30)烷基甲硅烷基、取代或未取代的二(c1-c30)烷基(c6-c30)芳基甲硅烷基、取代或未取代的(c1-c30)烷基二(c6-c30)芳基甲硅烷基、取代或未取代的三(c6-c30)芳基甲硅烷基、一个或多个(c3-c30)脂肪族环和一个或多个(c6-c30)芳香族环的取代或未取代的稠环、或-l
3-n(ar3)(ar4);
[0090]
l3各自独立地表示单键、取代或未取代的(c6-c30)亚芳基、或取代或未取代的(3元至30元)亚杂芳基;并且
[0091]
ar3和ar4各自独立地表示氢、取代或未取代的(c1-c30)烷基、取代或未取代的(c2-c30)烯基、一个或多个(c3-c30)脂肪族环和一个或多个(c6-c30)芳香族环的取代或未取代的稠环、取代或未取代的(c6-c30)芳基、或取代或未取代的(3元至30元)杂芳基。
[0092]
根据本公开的一个实施例,r
41
至r
44
各自独立地可以是氢。
[0093]
根据本公开的一个实施例,式a可以由下式a-1至a-3中的至少一个表示:
[0094]
[0095][0096]
其中
[0097]r21
至r
24
和x是如式1中所定义的;
[0098]r51
至r
54
各自独立地表示氢、氘、卤素、氰基、取代或未取代的(c1-c30)烷基、取代或未取代的(c6-c30)芳基、取代或未取代的(3元至30元)杂芳基、取代或未取代的(c3-c30)环烷基、取代或未取代的(c1-c30)烷氧基、取代或未取代的三(c1-c30)烷基甲硅烷基、取代或未取代的二(c1-c30)烷基(c6-c30)芳基甲硅烷基、取代或未取代的(c1-c30)烷基二(c6-c30)芳基甲硅烷基、取代或未取代的三(c6-c30)芳基甲硅烷基、一个或多个(c3-c30)脂肪族环和一个或多个(c6-c30)芳香族环的取代或未取代的稠环、或-l3′‑
n(ar3′
)(ar4′
);
[0099]
l3′
各自独立地表示单键、取代或未取代的(c6-c30)亚芳基、或取代或未取代的(3元至30元)亚杂芳基;并且
[0100]
ar3′
和ar4′
各自独立地表示氢、取代或未取代的(c1-c30)烷基、取代或未取代的(c2-c30)烯基、一个或多个(c3-c30)脂肪族环和一个或多个(c6-c30)芳香族环的取代或未取代的稠环、取代或未取代的(c6-c30)芳基、或取代或未取代的(3元至30元)杂芳基。
[0101]
根据本公开的一个实施例,r
51
至r
54
各自独立地可以是氢。
[0102]
由式1表示的化合物可以是选自以下化合物的至少一种,但不限于此。
[0103]
[0104]
[0105]
[0106]
[0107]
[0108]
[0109]
[0110]
[0111]
[0112]
[0113]
[0114]
[0115]
[0116]
[0117]
[0118]
[0119]
[0120]
[0121]
[0122]
[0123]
[0124]
[0125]
[0126]
[0127]
[0128]
[0129]
[0130]
是-o-;x1是-n=,并且y1是-s-;x1是-o-,并且y1是-n=;或者x1是-s-,并且y1是-n=。
[0135]
在式2中,r
61
表示取代或未取代的(c6-c30)芳基或取代或未取代的(3元至30元)杂芳基。根据本公开的一个实施例,r
61
表示取代或未取代的(c6-c30)芳基或取代或未取代的(5元至25元)杂芳基。根据本公开的另一个实施例,r
61
表示取代或未取代的(c6-c30)芳基或取代的(5元至20元)杂芳基。例如,r
61
可以是未取代的苯基、未取代的联苯基、未取代的萘基、被甲基取代的芴基、被甲基取代的苯并芴基、未取代的二苯并呋喃基、未取代的二苯并噻吩基、螺[芴-芴]基、螺[芴-苯并芴]基、未取代的吡啶基等。
[0136]
在式2中,r
62
至r
64
和r
67
各自独立地表示氢、氘、卤素、氰基、取代或未取代的(c1-c30)烷基、取代或未取代的(c6-c30)芳基、取代或未取代的(3元至30元)杂芳基、取代或未取代的(c3-c30)环烷基、取代或未取代的(c1-c30)烷氧基、取代或未取代的三(c1-c30)烷基甲硅烷基、取代或未取代的二(c1-c30)烷基(c6-c30)芳基甲硅烷基、取代或未取代的(c1-c30)烷基二(c6-c30)芳基甲硅烷基、取代或未取代的三(c6-c30)芳基甲硅烷基、一个或多个(c3-c30)脂肪族环和一个或多个(c6-c30)芳香族环的取代或未取代的稠环、或-l3″‑
n(ar3″
)(ar4″
);或者可以与相邻取代基连接形成环。在本文中,l3″
各自独立地表示单键、取代或未取代的(c6-c30)亚芳基、或取代或未取代的(3元至30元)亚杂芳基;并且ar3″
和ar4″
各自独立地表示氢、取代或未取代的(c1-c30)烷基、取代或未取代的(c2-c30)烯基、一个或多个(c3-c30)脂肪族环和一个或多个(c6-c30)芳香族环的取代或未取代的稠环、取代或未取代的(c6-c30)芳基、或取代或未取代的(3元至30元)杂芳基。
[0137]
根据本公开的一个实施例,r
62
至r
64
和r
67
各自独立地表示氢、或取代或未取代的(c6-c12)芳基。根据本公开的另一个实施例,r
62
至r
64
和r
67
各自独立地表示氢或未取代的(c6-c12)芳基。例如,r
62
和r
63
可以是氢,并且r
67
可以是氢、苯基等。
[0138]
在式2中,l4表示单键、取代或未取代的(c6-c30)亚芳基、或取代或未取代的(3元至30元)亚杂芳基。根据本公开的一个实施例,l4表示单键、或取代或未取代的(c6-c18)亚芳基。根据本公开的另一个实施例,l4表示单键、或未取代的(c6-c12)亚芳基。例如,l4可以是单键、未取代的亚苯基、未取代的亚萘基等。
[0139]
在式2中,r
65
和r
66
各自独立地表示取代或未取代的(c6-c30)芳基或取代或未取代的(3元至30元)杂芳基。根据本公开的一个实施例,r
65
和r
66
各自独立地表示取代或未取代的(c6-c25)芳基、或取代或未取代的(3元-20元)杂芳基。根据本公开的另一个实施例,r
65
和r
66
各自独立地表示未取代的或被氘、(c1-c6)烷基、(c6-c25)芳基、(3元至20元)杂芳基、(c3-c7)环烷基、和(c1-c6)烷基(c6-c12)芳基中的至少一个取代的(c6-c25)芳基;或未取代的或被(c6-c12)芳基和(5元至15元)杂芳基中的至少一个取代的(3元至20元)杂芳基。例如,r
65
和r
66
各自独立地可以是以下中的至少一个:取代的苯基、萘基、联苯基、菲基、二甲基芴基、二苯基芴基、萘基苯基、苯基萘基、二甲基苯并芴基、三联苯基、螺二芴基、苯并呋喃基、苯并噻吩基、未取代的或被苯基取代的二苯并噻吩基、未取代的或被苯基或吡啶基取代的二苯并呋喃基、被苯基取代的咔唑基、苯并萘并呋喃基、苯并萘并噻吩基、苯并呋喃并吡啶基等;其中取代的苯基的取代基可以是以下中的至少一个:被氘、甲基和叔丁基中的至少一个取代的苯基;蒽基;荧蒽基;苯基芴基;环己基;被苯基取代的吡啶基;吩噁嗪基;以及被苯基取代的苯并咪唑基。
[0140]
在式2中,a表示1;b和c各自独立地表示1或2,优选1;d表示1至4的整数,优选1或2;
并且当b至d是2或更大的整数时,每个r
62
至每个r
64
可以彼此相同或不同。
[0141]
由式2表示的化合物可以是选自以下化合物的至少一种,但不限于此。
[0142]
[0143]
[0144]
[0145]
[0146]
[0147][0148]
由式3表示的化合物可以是选自以下化合物的至少一种,但不限于此。
[0149]
[0150][0151]
由式4表示的化合物可以是选自以下化合物的至少一种,但不限于此。
[0152]
[0153]
[0154][0155]
可以将化合物c-1至c-695中的至少一种和化合物h1-1至h1-136、化合物h2-1至h2-35和化合物h4-1至h4-65中的至少一种组合以用于有机电致发光装置中。
[0156]
根据本公开的具有式1的化合物可以通过本领域技术人员已知的合成方法、例如通过参考以下反应方案1至4来制备,但不限于此。
[0157]
[反应方案1]
[0158][0159]
[反应方案2]
[0160][0161]
[反应方案3]
[0162][0163]
[反应方案4]
[0164][0165]
在反应方案1至4中,r1至r4、r
11
至r
14
、r
21
至r
24
、l1、l2、ar1和ar2是如式1中所定义的,并且hal是卤素原子。
[0166]
本公开的由式2表示的化合物可以通过本领域技术人员已知的合成方法来制备,例如,参考韩国专利申请公开号2017-0022865(2017年3月2日公布)、韩国专利申请公开号2017-0051198(2017年5月11日公布)、韩国专利申请公开号2018-0094572(2018年8月24日公布)等,但不限于此。
[0167]
本公开的由式3表示的化合物可以通过本领域技术人员已知的合成方法来制备。
[0168]
本公开的由式4表示的化合物可以参考韩国专利申请公开号2020-0026079(2020年3月10日公布)来制备,但不限于此。
[0169]
尽管以上描述了由式1表示的化合物的说明性合成实例,但是本领域技术人员将能够容易地理解它们全部基于布赫瓦尔德-哈特维希(buchwald-hartwig)交叉偶联反应、n-芳基化反应、酸化蒙脱土(h-mont)介导的醚化反应、宫浦(miyaura)硼化反应、铃木(suzuki)交叉偶联反应、分子内酸诱导的环化反应、pd(ii)催化的氧化环化反应、格氏反应(grignard reaction)、赫克反应(heck reaction)、脱水环合反应、sn1取代反应、sn2取代反应、膦介导的还原环化反应等,并且即使当键合了式1所定义但在具体合成实例中未指定的取代基时,上述反应也进行。
[0170]
本公开的有机电致发光装置可以包含具有式1的化合物。在此,具有式1的化合物可以包含在发光层中。
[0171]
此外,本公开的有机电致发光装置包括阳极、阴极、以及在阳极与阴极之间的至少一个有机层,其中该有机层可以包含多种有机电致发光材料,其包含由式1表示的化合物作为第一有机电致发光材料以及由式2至4中的任一个表示的化合物作为第二有机电致发光材料。根据本公开的一个实施例,本公开的有机电致发光装置包括阳极、阴极、以及在阳极与阴极之间的至少一个发光层,其中该发光层的至少一个层可以包含多种主体材料,其包含由式1表示的化合物作为第一主体材料和由式2至4中的任一个表示的化合物作为第二主体材料。
[0172]
电极可以是半透反射电极或反射电极,并且根据材料可以是顶部发射型、底部发射型、或两侧发射型。此外,空穴注入层可以另外掺杂有p型掺杂剂,并且电子注入层可以另外掺杂有n型掺杂剂。
[0173]
发光层包含一种或多种主体和掺杂剂,其中该主体包含多种主体材料,其中由式1表示的化合物可以作为该多种主体材料中的第一主体化合物被包含,并且由式2至4中的任一个表示的化合物可以作为该多种主体材料中的第二主体化合物被包含。在此,第一主体化合物与第二主体化合物的重量比是约1∶99至约99∶1、优选约10∶90至约90∶10、更优选约30∶70至约70∶30、更优选约40∶60至约60∶40、并且甚至更优选约50∶50。当一个层中包含两种或更多种材料时,它们可以混合蒸发或者分别且同时共蒸发以形成层。
[0174]
在本公开中,发光层是发出光的层,其可以是单层或其中堆叠了两个或更多个层的多个层。在本公开的多种主体材料中,第一和第二主体材料两者可以包含在一个层中或者分别包含在不同的发光层中。根据本公开的一个实施例,掺杂剂化合物的掺杂浓度相对于发光层的主体化合物可以小于20wt%。
[0175]
本公开的有机电致发光装置可以包括在阳极与发光层之间的空穴传输区。空穴传输区可以包括空穴注入层、空穴传输层、空穴辅助层、发光辅助层和电子阻挡层中的至少一个。空穴注入层、空穴传输层、空穴辅助层、发光辅助层和电子阻挡层可以分别是单层或其中堆叠了两个或更多个层的多个层。空穴注入层可以是多层以便降低从阳极到空穴传输层或电子阻挡层的空穴注入势垒(或空穴注入电压),其中在多层中的每一个中可以同时使用两种化合物。电子阻挡层可以放置在空穴传输层(或空穴注入层)与发光层之间,并且可以阻挡来自发光层的电子溢出并将激子限制在发光层中以防止漏光。
[0176]
此外,空穴传输区可以包括p型掺杂的空穴注入层、空穴传输层和发光辅助层。p型掺杂的空穴注入层意指掺杂有p型掺杂剂的空穴注入层。p型掺杂剂是有助于p型半导体特性的材料。p型半导体特性是指将空穴注入或传输至homo能级的特性,即具有高空穴传导率
的材料的特性。
[0177]
本公开的有机电致发光装置可以包括在发光层与阴极之间的电子传输区。电子传输区可以包括空穴阻挡层、电子传输层、电子缓冲层、以及电子注入层中的至少一个。空穴阻挡层、电子传输层、电子缓冲层、以及电子注入层可以分别是单层或其中堆叠了两个或更多个层的多个层。电子注入层可以另外掺杂有n型掺杂剂。电子缓冲层可以是多层,以便控制电子注入和改善发光层与电子注入层之间的界面特性,其中在多层的每一个中可以同时使用两种化合物。空穴阻挡层或电子传输层也可以是多层,其中多层中的每一个中可以使用多种化合物。根据本公开的一个实施例,电子传输区的至少一个层、优选电子缓冲层可以包含由式1表示的化合物。
[0178]
发光辅助层是放置在阳极与发光层之间或放置在阴极与发光层之间的层。当将发光辅助层放置在阳极与发光层之间时,它可以用于促进空穴注入和/或传输或用于防止电子溢出。当将发光辅助层放置在阴极与发光层之间时,它可以用于促进电子注入和/或传输或用于防止空穴溢出。此外,可以将发光辅助层放置在空穴传输层(或空穴注入层)与发光层之间,以展现出促进或阻挡空穴传输速率(或注入速率)的作用,从而使得能够控制电荷平衡。当有机电致发光装置包括两个或更多个空穴传输层时,另外包括的空穴传输层可以用作空穴辅助层或电子阻挡层。发光辅助层、空穴辅助层或电子阻挡层可以具有提高有机电致发光装置的效率和/或寿命的作用。
[0179]
可以包含在本公开的有机电致发光装置中的掺杂剂可以是至少一种磷光掺杂剂或荧光掺杂剂、优选磷光掺杂剂。应用于根据本公开的有机电致发光装置的磷光掺杂剂材料不受特别限制,但可以选自金属化的铱(ir)、锇(os)、铜(cu)和铂(pt)的络合化合物,可以优选地选自邻位金属化的铱(ir)、锇(os)、铜(cu)和铂(pt)的络合化合物,并且可以更优选地是邻位金属化的铱络合化合物。
[0180]
包含在本公开的有机电致发光装置中的掺杂剂可以是由下式101表示的化合物,但不限于此。
[0181][0182]
在式101中,
[0183]
l
′
选自以下结构1至3:
[0184][0185]r100
至r
103
各自独立地表示氢、氘、卤素、未取代的或被一个或多个氘和/或一个或多个卤素取代的(c1-c30)烷基、取代或未取代的(c3-c30)环烷基、取代或未取代的(c6-c30)芳基、氰基、取代或未取代的(3元至30元)杂芳基、或取代或未取代的(c1-c30)烷氧基;或者可以与相邻取代基连接以与吡啶一起形成一个或多个环,例如取代或未取代的喹啉、异喹啉、苯并呋喃并吡啶、苯并噻吩并吡啶、茚并吡啶、苯并呋喃并喹啉、苯并噻吩并喹啉、或茚并喹啉环;
[0186]r104
至r
107
各自独立地表示氢、氘、卤素、未取代的或被一个或多个氘和/或一个或多个卤素取代的(c1-c30)烷基、取代或未取代的(c3-c30)环烷基、取代或未取代的(c6-c30)芳基、取代或未取代的(3至30元)杂芳基、氰基、或取代或未取代的(c1-c30)烷氧基;或者可以与相邻取代基连接以与苯一起形成环,例如取代或未取代的萘、芴、二苯并噻吩、二苯并呋喃、茚并吡啶、苯并呋喃并吡啶、或苯并噻吩并吡啶环;
[0187]r201
至r
220
各自独立地表示氢、氘、卤素、未取代的或被一个或多个氘和/或一个或多个卤素取代的(c1-c30)烷基、取代或未取代的(c3-c30)环烷基、或取代或未取代的(c6-c30)芳基;或者可以与相邻取代基连接形成环;并且
[0188]
s表示1至3的整数。
[0189]
掺杂剂化合物的具体实例如下,但不限于此。
[0190]
[0191]
[0192]
[0193]
[0194]
[0195][0196]
本公开的有机电致发光装置的每个层可以通过以下方法中的任一种来形成:干法成膜方法如真空蒸发、溅射、等离子体、离子镀等,或湿法成膜方法如喷墨印刷、喷嘴印刷、狭缝式涂布、旋涂、浸涂、流涂等。
[0197]
当使用湿法成膜方法时,可以通过将形成每个层的材料溶解或扩散到任何合适溶剂如乙醇、氯仿、四氢呋喃、二噁烷等中来形成薄膜。对溶剂没有特别限制,只要形成每个层的材料在溶剂中是可溶的或可分散的,这在形成膜时不会引起任何问题。
[0198]
此外,由式1表示的化合物和由式2至4中的任一个表示的化合物可以通过以上列出的方法,通常通过共蒸发或混合蒸发方法形成。共蒸发是其中将两种或更多种材料放置在相应的单个坩埚源中并且同时向两个小室施加电流以蒸发材料的混合沉积方法。混合蒸发是其中使两种或更多种材料在蒸发之前在一个坩埚源中混合,并且向单元施加电流以蒸发材料的混合沉积方法。此外,当第一和第二主体化合物存在于有机电致发光装置中的同一层或不同层中时,则两种主体化合物可以分别单个地形成。例如,可以在蒸发第一主体化合物之后蒸发第二主体化合物。
[0199]
此外,根据本公开的有机电致发光材料可以被用作用于白色有机发光装置的发光材料。已经提出各种结构的白色有机发光装置,如并排结构或堆叠结构,取决于r(红色)、g(绿色)或yg(黄绿色)和b(蓝色)发光部件的布置,或颜色转换材料(ccm)方法等。本公开可以应用于此种白色有机发光装置。此外,根据本公开的有机电致发光材料还可以用于包含qd(量子点)的有机电致发光装置。
[0200]
本公开可以通过使用多种主体材料提供显示系统,该多种主体材料包含由式1表示的化合物和由式2至4表示的化合物中的任一种。即,可以通过使用本公开的有机电致发光化合物或多种主体材料来生产显示系统或照明系统。具体地,可以通过使用本公开的多种主体材料来生产显示系统,例如用于有机发光装置、智能手机、平板电脑、笔记本电脑、pc、tv或汽车的显示系统;或照明系统,例如室外或室内照明系统。
[0201]
在下文中,将参考本公开的代表性化合物来详细解释本公开化合物的制备方法及其特性,以及包含根据本公开的有机电致发光化合物或多种主体材料的有机电致发光装置的特性。以下实例仅描述包含根据本公开的化合物或多种主体材料的有机电致发光装置的特性,但是本公开不限于以下实例。
[0202]
实例1:化合物c-26的制备
[0203][0204]
化合物1-1的合成
[0205]
将3-溴-9,9,10,10-四甲基-9,10-二氢菲(30g,95.2mmol)、4,4,4
′
,4
′
,5,5,5
′
,5
′‑
八甲基-2,2
′‑
二(1,3,2-二氧杂环戊硼烷)(29.0g,114mmol)、pdcl2(pph3)2(3.34g,4.76mmol)、koac(23.3g,238mmol)和500ml的1,4-二噁烷添加到烧瓶中并溶解,之后在140℃下在回流下搅拌3小时。在反应完成之后,将混合物冷却至室温并通过二氧化硅过滤器分离,以获得化合物1-1(31.0g,产率:90%)。
[0206]
化合物1-2的合成
[0207]
将化合物1-1(14.0g,38.6mmol)、1-溴-2-硝基苯(8.20g,40.6mmol)、四(三苯基膦)钯(0)(4.47g,3.86mmol)和naoh(4.64g,116mmol)溶解在烧瓶中的130ml的thf和70ml的h2o的混合物中,并且将混合物在110℃下在回流下搅拌3小时。在反应完成之后,添加乙酸乙酯和水以分离有机层,并且使用二氧化硅过滤器来获得化合物1-2(17.0g,产率:116%)。
[0208]
化合物1-3的合成
[0209]
将化合物1-2(16.0g,44.8mmol)和pph3(29.4g,112mmol)溶解在烧瓶中的220ml的o-dcb中,并且将混合物在230℃下在回流下搅拌1天。在反应完成之后,将溶剂通过蒸馏去除并通过柱色谱法分离,以获得化合物1-3(6.50g,产率:45%)。
[0210]
化合物c-26的合成
[0211]
将化合物1-3(2.50g,7.68mmol)、2-(4-溴苯基)-4,6-二苯基-1,3,5-三嗪(3.13g,8.07mmol)、pd2(dba)3(0.350g,0.384mmol)、2-二环己基膦基-2
′
,6
′‑
二甲氧基联苯(s-phos)(0.315g,0.768mmol)和naot-bu(1.85g,19.2mmol)溶解在烧瓶中的70ml的邻二甲苯中,并且在180℃下在回流下搅拌1小时。在反应完成之后,将溶剂通过在减压下过滤去除并
(dba)3(0.741g,o.809mmol)、s-phos(0.664g,1.62mmol)、naot-bu(3.11g,32.4mmol)和80ml的邻二甲苯添加到烧瓶中,并在180℃下在回流下搅拌。在反应完成之后,将溶剂通过在减压下过滤去除,并且将残余物通过柱色谱法分离。向其中添加meoh,并且将所得固体在减压下过滤以获得化合物c-582(2.3g,产率:23.9%)。
[0225] mw熔点颜色c-582593.27188.4℃白色
[0226]
实例3:化合物h1-27的制备
[0227][0228]
化合物1的合成
[0229]
将二苯并呋喃-2-胺(20g,144.7mmol)、2-溴二苯并呋喃(23.8g,96.47mmol)、pd(oac)2(1.1g,4.82mmol)、2-二环己基膦基-2
′
,6
′‑
二甲氧基联苯(s-phos)(3.9g,9.65mmol)、naot-bu(13.9g,144.7mmol)和485ml邻二甲苯添加到烧瓶中,并且在160℃下搅拌3小时。在反应完成之后,将混合物冷却至室温。用乙酸乙酯萃取有机层,并且使用硫酸镁去除残余水分。将残余物干燥并通过柱色谱法分离以获得化合物1(4.9g,产率:10%)。
[0230]
化合物h1-27的合成
[0231]
将化合物1(4.9g,12.76mmol)、化合物2(4.2g,14.0mmol)、pd(dba3)2(0.584g,0.638mmol)、s-phos(0.523g,1.276mmol)、naot-bu(1.8g,19.14mmol)和65ml的邻二甲苯添加到烧瓶中,并且在160℃下搅拌2小时。在反应完成之后,将混合物冷却至室温。用乙酸乙酯萃取有机层,并且使用硫酸镁去除残余水分。将残余物干燥并通过柱色谱法分离以获得化合物h1-27(5.6g,产率:68.3%)。
[0232] mw熔点h1-27642.19237℃
[0233]
实例4:化合物h1-46的制备
[0234][0235]
将化合物3(25g,74.48mmol)、化合物2(42.58g,81.93mmol)、pd(oac)2(0.16g,7.5mmol)、p(t-bu)3(0.28g,7.5mmol)、naot-bu(14.31g,150mmol)和284.09ml的邻二甲苯添加到烧瓶中,并且在160℃下搅拌2小时。在反应完成之后,将混合物冷却至室温。用乙酸乙酯萃取有机层,并且使用硫酸镁去除残余水分。将残余物干燥并通过柱色谱法分离以获得化合物h1-46(23.4g,产率:50%)。
[0236] mw熔点h1-46628.22256.5℃
[0237]
实例5:化合物h1-43的制备
[0238][0239]
将化合物4(20g,56.96mmol)、化合物2(18.8g,57.13mmol)、pd(oac)2(0.13g,5.7mmol)、p(t-bu)3(0.22g,5.7mmol)、naot-bu(11g,113.92mmol)和227.27ml的邻二甲苯添加到烧瓶中,并且在160℃下搅拌2小时。在反应完成之后,将反应冷却至室温。用乙酸乙酯萃取有机层,并且使用硫酸镁去除残余水分。将残余物干燥并通过柱色谱法分离以获得化合物h1-43(12.5g,产率:34%)。
[0240] mw熔点h1-43644.19249℃
[0241]
实例6:化合物h1-123的制备
[0242][0243]
化合物5的合成
[0244]
将3-氨基联苯(54g,319mmol)、3-溴联苯(70g,301mmol)、pd(oac)2(0.33g,1.47mmol)、三环己基膦(0.84g,2.8mmol)、naot-bu(57g,593mmol)和280ml的甲苯添加到烧瓶中,并且在95℃下搅拌8小时。在反应完成之后,将混合物冷却至室温。用乙酸乙酯萃取有机层,并且使用硫酸镁去除残余水分。将残余物干燥并通过柱色谱法分离以获得化合物5(60.23g,产率:85%)。
[0245]
化合物h1-123的合成
[0246]
将化合物5(60.23g,187.5mmol)、化合物2(60g,182.33mmol)、pd(oac)2(0.41g,1.83mmol)、s-phos(1.74g,4.23mmol)、naot-bu(26.23g,272mmol)和300ml的二甲苯添加到烧瓶中,并且在110℃下搅拌10小时。在反应完成之后,将混合物冷却至室温。用乙酸乙酯萃取有机层,并且使用硫酸镁去除残余水分。将残余物干燥并通过柱色谱法分离以获得化合物h1-123(36.9g,产率:33%)。
[0247] mw熔点h1-123614.24210℃
[0248]
实例7:化合物h1-136的制备
[0249][0250]
化合物6的合成
[0251]
将二苯并呋喃-2-胺(29.24g,159.7mmol)、2-溴二苯并噻吩(40g,152.7mmol)、pd(oac)2(0.17g,0.75mmol)、三环己基膦(0.43g,1.45mmol)、naot-bu(29.22g,304mmol)和250ml的甲苯添加到烧瓶中,并且在95℃下搅拌8小时。在反应完成之后,将混合物冷却至室温。用乙酸乙酯萃取有机层,并且使用硫酸镁去除残余水分。将残余物干燥并通过柱色谱法分离以获得化合物6(17.12g,产率:86%)。
[0252]
化合物h1-136的合成
[0253]
将化合物6(17.12g,46.89mmol)、化合物2(15g,45.58mmol)、pd(oac)2(0.05g,0.22mmol)、s-phos(0.22g,0.535mmol)、naot-bu(6.56g,68.2mmol)和75ml的二甲苯添加到烧瓶中,并且在110℃下搅拌10小时。在反应完成之后,将混合物冷却至室温。用乙酸乙酯萃取有机层,并且使用硫酸镁去除残余水分。将残余物干燥并通过柱色谱法分离以获得化合物h1-136(10.2g,产率:34%)。
[0254] mw熔点
h1-136658.17254℃
[0255]
实例8:化合物h1-85的制备
[0256][0257]
将化合物2(5.0g,15.2mmol)、二([1,1
′‑
联苯基]-4-基)胺(4.9g,15.2mmol)、pd(oac)2(0.2g,0.8mmol)、p(t-bu)3(0.8ml,1.5mmol)、naot-bu(2.9g,30.4mmol)和76ml的二甲苯添加到烧瓶中,并且在160℃下搅拌5小时。在反应完成之后,将混合物冷却至室温。将沉淀的固体用蒸馏水和甲醇洗涤,并且通过柱色谱法分离以获得化合物h1-85(5.5g,产率:59%)。
[0258]
实例9:化合物h1-51的制备
[0259][0260]
将化合物2(4g,12mmol)、双(联苯基-4-基)[4-(4,4,5,5-四甲基-[1,3,2]-二氧杂环戊硼烷-2-基)苯基]胺(6.8g,13mmol)、pd(oac)2(0.3g,1mmol)、s-phos(0.9g,2mmol)、cs2co3(11.5g,35mmol)、60ml的邻二甲苯、15ml的etoh和15ml的蒸馏水添加到烧瓶中,并且在150℃下在回流下搅拌3小时。在反应完成之后,将混合物冷却至室温并用蒸馏水洗涤。将有机层用乙酸乙酯萃取,并且使用硫酸镁去除残余水分。将残余物干燥并通过柱色谱法分离以获得化合物h1-51(2.2g,产率:27%)。
[0261]
实例10:化合物h1-68的制备
[0262][0263]
将化合物7(4.8g,11.34mmol)、n-(4-溴苯基)-n-苯基-[1,1
′‑
联苯基]-4-胺(5g,12.47mmol)、pd(pph3)4(0.4g,0.34mmol)、na2co3(3.0g,28.35mmol)、57ml的甲苯、14ml的乙醇和14ml的蒸馏水添加到烧瓶中,并且在120℃下搅拌4小时。在反应完成之后,将混合物逐滴添加到甲醇中,并且过滤所得固体。将所得固体通过柱色谱法纯化以获得化合物h1-68
(1.4g,产率:20.0%)。
[0264]
实例11:化合物h1-15的制备
[0265][0266]
化合物8的合成
[0267]
将化合物2(10.0g,30.3mmol)、[1,1
′‑
联苯基]-3-胺(6.7g,39.4mmol)、pd(oac)2(0.34g,1.5mmol)、p(t-bu)3(1.5ml,3.03mmol)、naot-bu(5.8g,60.6mmol)和150ml的二甲苯添加到烧瓶中,并且在160℃下搅拌6小时。在反应完成之后,将混合物用蒸馏水洗涤。将有机层用乙酸乙酯萃取并使用硫酸镁干燥。通过旋转蒸发器去除溶剂。将残余物通过柱色谱法分离以获得化合物8(10.8g,产率:36%)。
[0268]
化合物h1-15的合成
[0269]
将化合物8(5.0g,10.8mmol)、3-溴二苯并呋喃(3.2g,12.9mmol)、pd2(dba)3(0.5g,0.54mmo1)、s-phos(0.45g,1.08mmol)、naot-bu(2.0g,21.6mmol)和60ml的邻二甲苯添加到烧瓶中,并且在160℃下搅拌6小时。在反应完成之后,将混合物冷却至室温。用乙酸乙酯萃取有机层,并且使用硫酸镁去除残余水分。将残余物干燥并通过柱色谱法分离以获得化合物h1-15(1.45g,产率:21%)。
[0270] mw熔点h1-15628.73205℃
[0271]
装置实例1:生产包含根据本公开的化合物的发射绿光的oled
[0272]
生产了包含根据本公开的有机电致发光化合物的oled。首先,将用于oled的玻璃基板上的透明电极铟锡氧化物(ito)薄膜(10ω/sq)(日本吉奥马有限公司(geomatec co.,ltd.,japan))用丙酮和异丙醇依次进行超声洗涤,并且然后在使用之前储存在异丙醇中。将ito基板安装在真空气相沉积设备的基板支架上。将化合物hi-1引入真空气相沉积设备的一个小室中,并将化合物ht-1引入另一个小室中。通过掺杂基于化合物hi-1和化合物ht-1的总量3wt%的量的化合物hi-1,将两种材料以不同的速率蒸发以沉积具有10nm厚度的空穴注入层。随后,将化合物ht-1引入真空气相沉积设备的小室中并通过向小室施加电流使该化合物蒸发,从而在空穴注入层上沉积具有80nm厚度的第一空穴传输层。随后,将化合物ht-2引入真空气相沉积设备的另一个小室中,并通过向小室施加电流使该化合物蒸发,从而在第一空穴传输层上沉积具有30nm厚度的第二空穴传输层。在形成空穴注入层和空穴传输层之后,如下在其上沉积发光层:将化合物c-26作为主体引入真空气相沉积设备的一个小室中,并且将化合物d-50作为掺杂剂引入另一个小室中,之后掺杂基于主体和掺杂剂的总量10wt%的量的掺杂剂,以在第二空穴传输层上沉积具有40nm厚度的发光层。随后,将化合物etl-1:化合物eil-1以40∶60的重量比蒸发,以在发光层上沉积具有35nm厚度的电子传
输层。在将化合物eil-1沉积为具有2nm厚度的电子注入层之后,通过另一真空气相沉积设备在电子注入层上沉积具有80nm厚度的al阴极以生产oled。每种材料的化合物在使用之前通过在10-6
托下真空升华来纯化。
[0273]
对比实例1:生产包含常规化合物作为主体的发射绿光的oled
[0274]
以与装置实例1中相同的方式生产oled,不同的是使用化合物cbp(4,4
′‑
n,n
′‑
二咔唑-联苯)作为发光层的主体材料,将balq(铝(iii)双(2-甲基-8-喹啉)4-苯基苯酚盐(aluminum(iii)bis(2-methyl-8-quinolinato)4-phenylphenolate))沉积至5nm的厚度作为空穴阻挡层,并且将化合物etl-1:化合物eil-1以40∶60的重量比蒸发,以在空穴阻挡层上沉积具有30nm厚度的电子传输层。
[0275]
如上所述制备的装置实例1和对比实例1的有机电致发光装置的基于1,000尼特的亮度的驱动电压、发光效率和发光颜色在以下表1中示出。
[0276]
[表1]
[0277][0278]
与使用对比实例1的主体材料的有机电致发光装置相比,使用根据本公开的主体材料的有机电致发光装置示出更低的驱动电压和更高的发光效率。此外,使用根据本公开的主体材料的有机电致发光装置可以具有优异的寿命特性。
[0279]
装置实例2和3:生产包含根据本公开的多种主体材料的发射红光的oled
[0280]
生产根据本公开的oled。首先,将用于oled的玻璃基板上的透明电极铟锡氧化物(ito)薄膜(10ω/sq)(日本吉奥马有限公司(geomatec co.,ltd.,japan))用丙酮和异丙醇依次进行超声洗涤,并且然后在使用之前储存在异丙醇中。将ito基板安装在真空气相沉积设备的基板支架上。将化合物hi-1引入真空气相沉积设备的一个小室中,并将化合物ht-1引入另一个小室中。通过掺杂基于化合物hi-1和化合物ht-1的总量3wt%的量的化合物hi-1,将两种材料以不同的速率蒸发以沉积具有10nm厚度的空穴注入层。随后,将化合物ht-1引入真空气相沉积设备的小室中并通过向小室施加电流使该化合物蒸发,从而在空穴注入层上沉积具有80nm厚度的第一空穴传输层。随后,将化合物ht-3引入真空气相沉积设备的另一个小室中,并通过向小室施加电流使该化合物蒸发,从而在第一空穴传输层上沉积具有60nm厚度的第二空穴传输层。在形成空穴注入层和空穴传输层之后,如下在其上沉积发光层:将如下表2中所示的第一主体化合物和第二主体化合物作为主体引入真空气相沉积设备的两个小室中,并且将化合物d-39作为掺杂剂引入另一个小室中。将两种主体材料以1∶1的比率蒸发,并且将掺杂剂材料以不同的比率同时蒸发,从而掺杂基于主体和掺杂剂的总量3wt%的量的掺杂剂,以在第二空穴传输层上沉积具有40nm厚度的发光层。随后,将化合物etl-1:化合物eil-1以50∶50的重量比蒸发,以在发光层上沉积具有35nm厚度的电子传输层。在电子传输层上沉积化合物eil-1作为具有2nm厚度的电子注入层之后,通过另一真空气相沉积设备在电子注入层上沉积具有80nm厚度的al阴极以生产oled。每种材料的化合物在使用之前通过在10-6
托下真空升华来纯化。
[0281]
对比实例2和3:生产包含常规化合物作为主体的发射红光的oled
[0282]
以与装置实例2和3中相同的方式生产oled,不同的是使用化合物cbp或化合物h1-9作为发光层的单一主体材料。
[0283]
如上所述制备的装置实例2和3以及对比实例2和3的有机电致发光装置的基于1,000尼特的亮度的驱动电压、发光效率和发光颜色以及基于5,000尼特的亮度的亮度从100%降低至95%所花费的时间(寿命:t95)在以下表2中示出。
[0284]
[表2]
[0285][0286]
与使用对比实例2和3的主体材料的有机电致发光装置相比,使用根据本公开的多种主体材料的有机电致发光装置示出更低的驱动电压、更高的发光效率和优异的寿命特性。
[0287]
装置实例4:生产包含根据本公开的多种主体材料的发射绿光的oled
[0288]
生产根据本公开的oled。首先,将用于oled的玻璃基板上的透明电极铟锡氧化物(ito)薄膜(10ω/sq)(日本吉奥马有限公司(geomatec co.,ltd.,japan))用丙酮和异丙醇依次进行超声洗涤,并且然后在使用之前储存在异丙醇中。将ito基板安装在真空气相沉积设备的基板支架上。将化合物hi-1引入真空气相沉积设备的一个小室中,并将化合物ht-1引入另一个小室中。通过掺杂基于化合物hi-1和化合物ht-1的总量3wt%的量的化合物hi-1,将两种材料以不同的速率蒸发以沉积具有10nm厚度的空穴注入层。随后,将化合物ht-1引入真空气相沉积设备的小室中并通过向小室施加电流使该化合物蒸发,从而在空穴注入层上沉积具有80nm厚度的第一空穴传输层。随后,将化合物ht-2引入真空气相沉积设备的另一个小室中,并通过向小室施加电流使该化合物蒸发,从而在第一空穴传输层上沉积具有30nm厚度的第二空穴传输层。在形成空穴注入层和空穴传输层之后,如下在其上沉积发光层:将化合物c-26和化合物h2-2作为主体引入真空气相沉积设备的小室中,并且将化合物d-130作为掺杂剂引入另一个小室中。将两种主体材料以2∶1的不同比率蒸发,并且将掺杂剂材料以不同的比率同时蒸发,从而掺杂基于主体和掺杂剂的总量10wt%的量的掺杂剂,以在第二空穴传输层上沉积具有40nm厚度的发光层。随后,将化合物etl-1:化合物eil-1以40∶60的重量比蒸发,以在发光层上沉积具有35nm厚度的电子传输层。在电子传输层上沉积化合物eil-1作为具有2nm厚度的电子注入层之后,通过另一真空气相沉积设备在电子注入层上沉积具有80nm厚度的al阴极以生产oled。每种材料的化合物在使用之前通过在10-6
托下真空升华来纯化。
[0289]
对比实例4:生产包含常规化合物作为主体的发射绿光的oled
[0290]
以与装置实例4中相同的方式生产oled,不同的是使用化合物h2-2作为发光层的单一主体材料。
[0291]
如上所述制备的装置实例4和对比实例4的有机电致发光装置的基于1,000尼特的亮度的驱动电压、发光效率和发光颜色在以下表3中示出。
[0292]
[表3]
[0293][0294]
与使用对比实例4的主体材料的有机电致发光装置相比,使用根据本公开的多种主体材料的有机电致发光装置示出更低的驱动电压和更高的发光效率。此外,使用根据本公开的多种主体材料的有机电致发光装置可以具有优异的寿命特性。
[0295]
不受理论的限制,在其中具有式1的二氢菲骨架中的所有r
11
至r
14
是氢的化合物情况下,易于通过光辐射将其转化为具有菲骨架的化合物(例如,菲并吲哚结构)。具有菲骨架的化合物(例如,菲并吲哚)可能起到杂质的作用,因为菲比二氢菲具有更低的三重态能隙。在这种情况下,oled的特征可能劣化。本公开努力通过将保护基团如甲基引入r
11
至r
14
中来解决这种问题。具体地,在引入甲基时,homo能和lumo能不受影响。
[0296]
[表4]
[0297]
