1.本技术涉及造血干细胞培养及扩增领域,以及与造血干细胞移植相关的治疗产品及疾病疗法。
背景技术:
2.造血干细胞(hematopoietic stem cells,hscs)是血液系统中一群异质原始造血细胞,具有自我更新和多谱系分化两个重要特征。从骨髓、动员外周血细胞、脐带血、胎儿造血系统、胚胎干细胞等分离出的造血干细胞通常包含:长期造血干细胞(lt-hsc,可终生保持自我更新和多谱系分化潜能);短期造血干细胞(st-hsc,具有多谱系分化能力,但自我更新潜能有限,通常其重建髓系和/或淋巴系间隔时间很短,大约六周);以及造血祖细胞(hpc,几乎没有自我更新能力,需要依靠造血干细胞的增殖来补充,并且失去多谱系分化潜能,只能向一个或几个血细胞系定向增殖分化)。
3.机体处于健康状态时,体内hscs长期处于静息状态,当机体发生病变或严重失血时,hscs被激活,进入自我更新、多系分化状态,以维持血液系统稳定及机体稳态。hscs自我更新特性有利于子代hscs保持干性,而hscs多系分化特性可使其分化成多种成熟血细胞,如髓系细胞(粒细胞、单核细胞、红细胞及血小板),淋系细胞(t细胞和b细胞)。正因为hscs的特性,以及处于血液系统且具有的迁移、归巢能力,有利于hscs在机体需要时进行分化,以及在机体稳态时归巢至骨髓微环境发挥功能。
4.hscs的这些特性,使通过造血干细胞移植(hematopoietic stem cell transplantation,hsct)治疗血液系统疾病成为可能。1959年,thomas等人利用骨髓造血干细胞进行了人类历史上首次造血干细胞移植,在临床治疗白血病,以恢复病人体内正常造血功能。此后几十年,经过科研工作者的不断努力,造血干细胞移植不仅应用于治疗多种血液系统疾病,还被用于治疗免疫缺陷疾病等。如1996年,kapelushnik等人用外周血造血干细胞移植治疗β-地中海贫血(β-thalassemia)。1999年,cavazzana-calvo等人用骨髓造血干细胞对x连锁严重联合免疫缺陷病(severe combined immunodeficiency disease,xscid)患儿进行基因治疗。此项治疗成功治愈了xscid。
5.目前,hscs主要有三个来源,骨髓(bone marrow,bm)、动员外周血(mobilized peripheral blood,mpb)、脐带血(umbilical cord blood,cb)。直接从骨髓采集造血干细胞,创伤性大,采集量不足,该方法基本被淘汰。人外周血中hscs所占比例太低(小于0.1%),需要用粒细胞集落刺激因子(g-csf)等动员造血干细胞从骨髓中迁移至外周血中再进行采集和移植,临床应用中常出现动员效果不佳、所含hscs数量不足,导致多次动员或移植失败。并且这两种方法所采集的hscs均需要进行供者和患者之间白细胞抗原(human leukocyte antigen,hla)配型。hla配型比较困难,一旦发生错配,则会产生移植物抗宿主反应(graft versus host reaction,gvhd)。大量发生gvhd的患者会死于免疫系统紊乱。
6.脐带血作为一种新的hscs来源具有多方面优势,首先脐带血hscs对hla配型相合程度要求低,允许hla部分错配,移植后gvhd发病率低,缓解了传统hscs配型困难;其次脐带
血采集方便,对供者无伤害且不存在伦理问题,hscs造血能力强。这些优势使脐带血成为未来hscs治疗疾病的优先来源。
7.但由于单份脐带血细胞量少,总体hscs数量较少,且难以在体外进行扩增和培养,脐带血hscs中的lt-hsc(长期造血干细胞,long time-hematopoietic stem cell),例如表达cd34+/cd45+/cd45ra-/cd90+/cd38-的造血干细胞的比例在培养过程中往往维持在较低水平(~1%),同时lt-hsc细胞数量也几乎没有增殖,因此单份脐带血仅能用于儿童或体重较轻的成人移植,不能满足较大体重成人的移植需求。当移植hscs数量不足时,患者中性粒细胞恢复延迟,导致gvhd风险提高。这些都成为制约脐带血临床应用的瓶颈。
8.总之,造血干细胞移植的安全性和有效性取决于移植的hscs含量和质量,若能在体外扩增hscs的数量的同时,保证其质量(保持造血干细胞的干性),则可提高造血干细胞移植的成功率。
9.早期研究发现,利用细胞生长因子scf、flt-3l、tpo、il-3、il-6等,可以体外扩增hsc,但是体内功能验证试验结果不理想。后续一些信号通路的激活剂和抑制剂被相继发现在维持和扩增hsc上有正向作用。其中一种思路是靶向调控造血干细胞的代谢信号通路关键因子,通过改变细胞的代谢状态实现造血干细胞的扩增。调控造血干细胞信号通路可以通过添加小分子化合物(small-molecule compounds,smcs)实现。例如ahr芳烃受体抑制剂stemregenin 1(sr1),是筛选出的第一个可体外扩增hscs的smc(anthony e.boitano,etc,science.2010sep 10;329(5997):1345-1348)。此外还有wnt信号通路激活剂chir、mtor信号抑制剂rapamycin等。虽然取得长足进步,体外扩增效果明显,但是以上小分子或相关蛋白只是扩增了造血祖细胞,而对真正的lt-hsc并没有明显的扩增效果。2014年,um729/um171小分子被发现及改造后,已能够实现对lt-hsc的体外扩增。嘧啶吲哚衍生物um171(iman fares,etc,science.2014sep 19;345(6203):1509-12)体外扩增hscs没有下调ahr细胞信号传导通路,但抑制了红细胞、巨核细胞分化相关基因。当um171与ahr二者组合,对hscs的扩增倍数提高,但其临床结果尚有待观察。该领域所面临的hsc不足的问题仍未能有效解决。因此,研究新的化学小分子和相关信号通路以此扩增hsc仍具有重大价值。
技术实现要素:
10.技术问题
11.现有技术方法能够在体外对造血干细胞实现明显的扩增,但是这种扩增往往只是扩增了造血祖细胞,而极少有方法能够明显扩增具有长期自我更新能力的lt-hsc,且同时能够长期维持造血干细胞的定植分化及重建造血系统的能力。
12.技术方案
13.一方面,本技术提供了一种用于扩增造血干细胞的培养基组合物,包含在向维持造血干细胞存活的细胞培养基中添加的肝素酶。在一些实施方案中,所述的肝素酶为肝素酶i。在一些实施方案中,所述肝素酶的浓度为约1~9u/ml、1.5~8.5u/ml、2~8u/ml、2.5~7.5u/ml、3~7u/ml、3.5~6.5u/ml、4~6u/ml或4.5~5.5u/ml。在一些实施方案中,所述的组合物进一步包括组蛋白去乙酰化酶(hdac)抑制剂。在一些实施方案中,所述hdac抑制剂选自如下所列的化合物之一或其组合:辛二酰苯胺异羟肟酸(saha)和丙戊酸(valproic acid,vpa)。在一些实施方案中,所述hdac抑制剂为vpa,浓度为约5μm-1mm、100μm-900μm、
200μm-800μm、300μm-700μm、400μm-600μm或450μm-550μm。本技术中,维持造血干细胞存活的细胞培养基可以是任何商购的维持细胞存活,例如维持造血干细胞存活的细胞培养基,例如stemspantmsfem ii、imdm、df12、knockout dmem、rpmi 1640、alpha mem、dmem培养基,也可以是自行配制的用于维持细胞存活的任何培养基。配制维持细胞存活,例如维持造血干细胞存活的培养基是本领域技术人员掌握的现有技术。在一些实施方案中,维持造血干细胞存活的细胞培养基中包含有助于细胞、尤其是造血干细胞生长和增殖的一种或多种细胞因子,例如干细胞因子scf、g-csf、il-3、tgf-β、il-6、tpo。在一些实施方案中,所述培养基组合物还包含促进造血干细胞生长和增殖的化合物,例如人fms样酪氨酸激酶配体(flt-3l)、血管生成素样蛋白(angptl3)和/或notch配体。在一些实施方案中,所述培养基组合物还包含选自如下的一项或多项:ahr芳烃受体抑制剂stemregenin 1(sr1)、wnt信号通路激活剂chir、mtor信号抑制剂rapamycin、吲哚嘧啶衍生物um729、um171、jnk信号通路抑制剂。在一些实施方案中,所述基础培养基包括stemspantmsfem ii、imdm、df12、knockout dmem、rpmi 1640、alpha mem、dmem培养基。本技术所述干性,是指造血干细胞保持自我更新能力及具有分化成多种功能细胞的潜能的特性。在一些实施方案中,本技术所述造血干细胞是来源于骨髓细胞、外周血细胞、脐带血细胞或胚胎干细胞。在一些实施方案中,造血干细胞为cd34+(cd34阳性)的细胞群体。
14.在本技术中,维持造血干细胞存活的细胞培养基指本领域技术人员所知晓的任意适宜于体外培养细胞的培养基。所述细胞培养基可以是市售的,也可以是自行配制的,例如在基础培养基的基础上添加一种或多种适宜细胞生长和增殖的化合物配制而成的。本领域技术人员可以理解,任何常用的细胞培养基均可以用作细胞培养基,例如维持造血干细胞存活的细胞培养基,例如购自stem cell techonologies的stemspantmsfem ii、购自thermo fisher的imdm、df12、knockout dmem、rpmi 1640、alpha mem、dmem等商业化培养基。在优选的一些实施方案中,维持造血干细胞存活的细胞培养基中包含有助于细胞、尤其是造血干细胞生长和增殖的一种或多种细胞因子,例如干细胞因子scf、g-csf、il-3、tgf-β、il-6、tpo。在一些实施方案中,所述培养基组合物还包含促进造血干细胞生长和增殖的化合物,例如人fms样酪氨酸激酶配体(flt-3l)、血管生成素样蛋白(angptl3)和/或notch配体。在一些实施方案中,所述培养基组合物还包含选自如下的一项或多项:ahr芳烃受体抑制剂stemregenin 1(sr1)、wnt信号通路激活剂chir、mtor信号抑制剂rapamycin、吲哚嘧啶衍生物um729、um171、jnk信号通路抑制剂。
15.在一些实施方案中,所述细胞培养基是适宜于造血干细胞生长和增殖的细胞培养基。适宜于造血干细胞生长和增殖的细胞培养基可以是市售的任何培养基。在一些实施方案中,所述细胞培养基是适宜于造血干细胞生长和增殖的细胞培养基,例如在市售的细胞培养基(例如例如购自stem cell techonologies的stemspantmsfem ii、购自thermo fisher的imdm、df12、knockout dmem、rpmi 1640、alpha mem或dmem)的基础上进一步添加一种或多种已知的、可以促进造血干细胞生长和增殖的化合物的培养基。所述化合物例如细胞因子、小分子化合物、配体蛋白(例如人fms样酪氨酸激酶配体(flt-3l)、血管生成素样蛋白(angptl3)、notch配体)。在一些实施方案中,所述细胞培养基是适宜于造血干细胞体外培养的细胞培养基。适宜于造血干细胞体外培养的细胞培养基可以是包含基础培养基以及各种现有技术已知的干细胞生长所需成分自行配制的培养基。在一些实施方案中,适宜
于造血干细胞体外培养的细胞培养基包含例如its(即主要包括胰岛素、人转铁蛋白以及硒元素)、l-谷氨酰胺、维生素c和/或牛血清白蛋白。在一些实施方案中,所述适宜于造血干细胞体外培养的培养基可以含有血清。在一些实施方案中,所述适宜于造血干细胞体外培养的培养基包括imdm培养基、its、2mm l-谷氨酰胺、10-50μg/ml维生素c以及0.5-5质量%的bsa(牛血清白蛋白)。在一些实施方案中,所述适宜于造血干细胞体外培养的培养基包括上述df12、its、l-谷氨酰胺、维生素c和牛血清白蛋白。在一些实施方案中,所述适宜于造血干细胞体外培养的培养基包括knockout dmem、its、l-谷氨酰胺、维生素c和牛血清白蛋白;在一些实施方案中,所述适宜于造血干细胞体外培养的培养基包括rpmi 1640、its、l-谷氨酰胺、维生素c和牛血清白蛋白。在一些实施方案中,所述适宜于造血干细胞体外培养的培养基包括alpha mem、its、l-谷氨酰胺、维生素c和牛血清白蛋白。在一些实施方案中,所述适宜于造血干细胞体外培养的培养基包括dmem、its、l-谷氨酰胺、维生素c和牛血清白蛋白。
16.在一些实施方案中,细胞培养基是适宜于造血干细胞体外培养的细胞培养基,包含细胞培养基(例如选自stemspantmsfem ii、imdm、df12、knockout dmem、rpmi 1640、alpha mem和dmem的商购细胞培养基)和干细胞因子scf、人fms样酪氨酸激酶配体(flt-3l)、g-csf、il-3、血管生成素样蛋白(angptl3)、tgf-β、notch配体、il-6和tpo。在一些实施方案中,适宜于造血干细胞体外培养的细胞培养基包含stemspantmsfem ii(购自stem cell techonologies),50-200ng/ml scf,50-200ng/ml flt3-l,10-100ng/ml il-6,50-200ng/ml tpo,50-200ng/ml tgf-β,10-100ng/ml notch配体。在一些实施方案中,所述适宜于造血干细胞体外培养的培养基包含stemspantmsfem ii(购自stem cell techonologies)、100ng/ml scf、100ng/ml flt3-l、20ng/ml il-6、100ng/ml tpo、50ng/ml tgf-β、50ng/ml notch配体。
17.在一些实施方案中,上述适宜于造血干细胞体外培养的细胞培养基还包含促进造血干细胞体外生长、增殖的小分子化合物。在一些实施方案中,所述小分子化合物选自以下的一种或多种化合物:ahr芳烃受体抑制剂stemregenin 1(sr1)、wnt信号通路激活剂chir、mtor信号抑制剂rapamycin、吲哚嘧啶衍生物um729、um171、jnk信号通路抑制剂。在一些实施方案中,本技术所述适宜于造血干细胞体外培养的培养基还可以包含以上所述通路的其他抑制剂,例如针对以上信号通路的shrna,sirna,rnai,抗体及配体等。在一些实施方案中,所述培养基包含的小分子化合物为20nmol/ml-1μmol/mlum171。在一些实施方案中,所述培养基包含的小分子化合物为350nmol/mlum171。
18.本技术提供一种用于扩增造血干细胞的培养基组合物,包含细胞培养基和肝素酶。所述肝素酶,是指一类作用于肝素或者乙酰肝素分子的多糖裂解酶。在一些实施方案中,所述肝素酶可以通过酶切肝素位点,去除细胞表面的apoe(载脂蛋白e)。
19.在一些实施方案中,本技术提供的扩增造血干细胞的培养基组合物中包含的肝素酶为肝素酶i。在一些实施方案中,所述肝素酶i的使用浓度为约0.5u~10u,例如:1~9u/ml、1.5~8.5u/ml、2~8u/ml、2.5~7.5u/ml、3~7u/ml、3.5~6.5u/ml、4~6u/ml、4.5~5.5u/ml。
20.在一些实施方案中,所述扩增造血干细胞的培养基组合物还进一步包含hdac(组蛋白去乙酰化酶)抑制剂。在一些实施方案中,所述hdac抑制剂包括:异羟肟酸类、羧酸类、苯甲酰胺类、亲电酮类、环肽类hdac抑制剂。所述异羟肟酸类hdac抑制剂包括tsa、saha、
cbha、laq-824、pxd101、pyroxamide等;羧酸类hdac抑制剂包括丙戊酸(vpa)、丁酸钠、本基丁酸化合物an29等;苯甲酰胺类hdac抑制剂包括ms-275、ci-994等;亲电酮类hdac抑制剂包括三氟甲基酮、α-酮酰胺等;环肽类包括fk228等。在一些实施方案中,所述hdac抑制剂为vpa。在一些实施方案中,所述vpa的使用浓度选自以下的任一项:5μm-1mm、100μm-900μm、200μm-800μm、300μm-700μm、400μm-600μm、450μm-550μm。在一些实施方案中,所述vpa的使用浓度为约500μm。
21.本技术还提供了一种用于扩增造血干细胞和/或延长其干性保持时间的试剂盒,包含如前所述的用于扩增造血干细胞的培养基组合物。所述组合物中的一种或多种成分可存在于试剂盒中的不同容器中,亦可存在于同一容器中。
22.本技术还提供了一种扩增造血干细胞的方法,包括用以上所述的扩增造血干细胞的培养基组合物培养造血干细胞。在一些实施方案中,所述造血干细胞中的长期造血干细胞(lt-hsc)通过适当时间培养后扩增,并且干性保持。在一些实施方案中,所述lt-hsc为cd34+cd45+cd90+cd45ra-cd38-造血干细胞。在一些实施方案中,所述造血干细胞通过6-21天,6-18天,6-16天,6-15天,6-14天,6-13天,6-12天,6-11天,6-10天,6-9天或6-8天培养后扩增并且干性保持。在一些实施方案中,所述造血干细胞是来源于骨髓细胞、外周血细胞、脐带血细胞或胚胎干细胞。在一些实施方案中,经过培养,造血干细胞培养物中cd34+cd45+cd90+cd45ra-cd38-造血干细胞总数占造血干细胞培养后终末细胞总数的3%-50%、5%-50%、7%-50%、9%-50%、11%-50%、13%-50%、15%-50%、17%-50%、19%-50%、21%-50%、23%-50%、25%-50%、27%-50%、29%-50%、31%-50%、33%-50%、35%-50%、37%-50%、39%-50%、41%-50%、43%-50%、45%-50%、47%-50%、49%-50%。本技术所述“培养终末细胞”是指从骨髓、外周血、或脐带血等来源提取的造血干细胞经一段时间的培养后,例如经过6-21天,6-18天,6-16天,6-15天,6-14天,6-13天,6-12天,6-11天,6-10天,6-9天或6-8天培养后,在不经任何筛选的情况下计数的活细胞总量。
23.在一些实施方案中,所述扩增造血干细胞是指扩增造血干细胞并延长其干性保持时间,尤其是扩增lt-hsc(长期造血干细胞)并延长其干性保持时间。所述lt-hsc可通过其细胞表面标志物进行鉴定,所述细胞表面标志物表征包括:cd34+、cd45+(cd45阳性)、cd90+(cd90阳性)、cd45ra-(cd45ra阴性)、cd38-(cd38阴性)。
24.本技术所述干性,是指造血干细胞保持自我更新能力及具有分化成多种功能细胞的潜能的特性。本技术还提供了通过本技术的扩增造血干细胞并延长其干性保持时间的方法制备的造血干细胞的培养物和组合物。本技术提供了一种培养获得的造血干细胞培养物或造血干细胞组合物,其中cd34+cd45+cd90+cd45ra-cd38-造血干细胞总数占培养终末细胞总数的3%-50%、5%-50%、7%-50%、9%-50%、11%-50%、13%-50%、15%-50%、17%-50%、19%-50%、21%-50%、23%-50%、25%-50%、27%-50%、29%-50%、31%-50%、33%-50%、35%-50%、37%-50%、39%-50%、41%-50%、43%-50%、45%-50%、47%-50%、49%-50%。在具体的实施方案中,上述造血干细胞培养物或造血干细胞组合物是通过本技术上述培养方法培养获得的。
25.本技术还提供了肝素酶,例如肝素酶i用于促进造血干细胞扩增和/或维持其干性的作用。本技术还提供了肝素酶,例如肝素酶i用作细胞培养基添加剂的用途。
26.本技术还提供了肝素酶,例如肝素酶i和vpa的组合用作细胞培养基添加剂的用
途。肝素酶和vpa的组合用于扩增造血干细胞并维持其干性的用途。在一些实施方案中,所述肝素酶为肝素酶i。
27.本技术还提供了一种疾病治疗的方法,包括将经过前述用于扩增造血干细胞和/或延长其干性保持时间的方法培养的造血干细胞移植入患者体内,用于疾病的治疗。在一些实施方案中,所述疾病包括选自以下的任一种:移植物抗宿主病、自身免疫病或造血系统病症。在一些实施方案中,所述疾病选自包括以下任一种的自身免疫病:类风湿性关节炎、系统性红斑狼疮、多发性硬化症、i型糖尿病、系统性硬化症等;在一些实施方案中,所述疾病选自包括以下任一种的造血系统病症:急性髓性白血病、急性淋巴细胞白血病、慢性髓性白血病、慢性淋巴细胞白血病、骨髓增殖性疾病、骨髓增生异常综合征、多发性骨髓瘤、非霍奇金淋巴瘤、霍奇金病、再生障碍性贫血、单纯红细胞再生障碍、阵发性睡眠性血红蛋白尿症、珠蛋白生成障碍性贫血、镰状细胞性贫血、重症联合免疫缺陷、嗜血细胞性淋巴组织细胞增生和先天性代谢缺陷等。在一些实施方案中,所述疾病可以是因病毒感染而引起的血液系统或免疫系统疾病,例如艾滋病等。
28.本技术还提供了用于扩增造血干细胞和/或延长其干性保持时间的细胞培养基添加剂组合,为肝素酶i和vpa。在一些实施方案中,所述细胞培养基添加剂中的肝素酶i的使用浓度为约1~9u/ml、1.5~8.5u/ml、2~8u/ml、2.5~7.5u/ml、3~7u/ml、3.5~6.5u/ml、4~6u/ml、4.5~5.5u/ml;所述vpa的使用浓度为约选自以下的任一项:5μm-1mm、100μm-900μm、200μm-800μm、300μm-700μm、400μm-600μm、450μm-550μm。
29.具体地,本技术涉及以下各项:
30.1.一种用于扩增造血干细胞的培养基组合物,包含向维持造血干细胞存活的细胞培养基和中加入的肝素酶。
31.2.项1所述的培养基组合物,其中所述肝素酶为肝素酶i。
32.3.项1-2中任一项所述的组合物,其中所述肝素酶的浓度为约1~9u/ml、1.5~8.5u/ml、2~8u/ml、2.5~7.5u/ml、3~7u/ml、3.5~6.5u/ml、4~6u/ml或4.5~5.5u/ml。
33.4.项1-3中任一项所述的培养基组合物,其进一步包括包含向维持造血干细胞存活的细胞培养基中加入的组蛋白去乙酰化酶(hdac)抑制剂。
34.5.项4所述的培养基组合物,其中所述hdac抑制剂选自如下所列的化合物之一或其组合:辛二酰苯胺异羟肟酸(saha)和丙戊酸(valproic acid,vpa)。
35.6.项5所述的培养基组合物,其中所述hdac抑制剂为vpa,浓度为约5μm-1mm、100μm-900μm、200μm-800μm、300μm-700μm、400μm-600μm或450μm-550μm。
36.7.项1-6中任一项所述的培养基组合物,其中所述维持造血干细胞存活的细胞培养基选自如下的任一项:stemspantmsfem ii、imdm、df12、knockout dmem、rpmi 1640、alpha mem、dmem培养基。
37.8.项7所述的培养基组合物,其中所述维持造血干细胞存活的细胞培养基包含选自如下的一项或多项细胞因子:干细胞因子scf、g-csf、il-3、tgf-β、il-6、tpo。
38.9.项8所述的培养基组合物,其中所述维持造血干细胞存活的细胞培养基还包含选自如下的一项或多项:人fms样酪氨酸激酶配体(flt-3l)、血管生成素样蛋白(angptl3)、notch配体。
39.10.项1-9任一项所述的培养基组合物,还包含选自如下的一项或多项:ahr芳烃受
体抑制剂stemregenin 1(sr1)、wnt信号通路激活剂chir、mtor信号抑制剂rapamycin、吲哚嘧啶衍生物um729、um171、jnk信号通路抑制剂。
40.11.一种扩增造血干细胞的方法,包括用项1-10任一项的扩增造血干细胞的培养基组合物培养造血干细胞。
41.12.项11的方法,其中所述造血干细胞中的长期造血干细胞(lt-hsc)通过适当时间培养后扩增,并且同时保持干性保持。
42.13.项12的方法,其中所述lt-hsc为cd34+cd45+cd90+cd45ra-cd38-造血干细胞。
43.14.项11-13任一项的方法,其中所述造血干细胞通过6-21天,6-18天,6-16天,6-15天,6-14天,6-13天,6-12天,6-11天,6-10天,6-9天或6-8天培养后扩增并且同时保持干性保持。
44.15.一种经项11-14中任一项的方法培养获得的造血干细胞培养物或造血干细胞组合物,其中cd34+cd45+cd90+cd45ra-cd38-造血干细胞总数占培养终末细胞的3%-50%。
45.16.肝素酶用作用于扩增造血干细胞并维持其干性的培养基添加剂的用途。
46.17.项16的用途,其中所述肝素酶为肝素酶i。
47.18.肝素酶和vpa的组合用于扩增造血干细胞并维持其干性的用途。
48.19.项18的用途,其中所述肝素酶为肝素酶i。
49.20.一种扩增造血干细胞并延长其干性保持时间的方法,包括使用项1-10中任一项的扩增造血干细胞的培养基组合物培养造血干细胞。
50.21.项20的方法,其中所述造血干细胞经培养6-21天,6-18天,6-16天,6-15天,6-14天,6-13天,6-12天,6-11天,6-10天,6-9天或6-8天后仍然保持干性。
51.22.项20-21任一项的方法,其中经培养后所述cd34+cd45+cd90+cd45ra-cd38-造血干细胞总数占培养终末细胞的3%-50%。
52.23.一种造血干细胞培养物,其中cd34+cd45+cd90+cd45ra-cd38-造血干细胞总数占培养物中细胞总数的3%-50%。
53.24.项15的造血干细胞培养物或造血干细胞组合物或项23的造血干细胞培养物在制备治疗疾病的药物中的用途。
54.25.项24中所述的用途,其中所述患者所患疾病选自以下任一种:遗传免疫缺陷、自身免疫病或造血系统病症。
55.26.项25的用途,其中所述疾病选自:类风湿性关节炎、系统性红斑狼疮、多发性硬化症、i型糖尿病、系统性硬化症、急性髓性白血病、急性淋巴细胞白血病、慢性髓性白血病、慢性淋巴细胞白血病、骨髓增殖性疾病、骨髓增生异常综合征、多发性骨髓瘤、非霍奇金淋巴瘤、霍奇金病、再生障碍性贫血、单纯红细胞再生障碍、阵发性睡眠性血红蛋白尿症、珠蛋白生成障碍性贫血、镰状细胞性贫血、重症联合免疫缺陷、嗜血细胞性淋巴组织细胞增生、先天性代谢缺陷、艾滋病。
56.有益效果
57.如本领域技术人员所知,由于lt-hsc可终生保持自我更新和多谱系分化潜能,因此其在体外的维持与扩增是保持hsc干性,并成功扩增可用于临床移植的造血干细胞的关键。从实施例中的结果可知,在体外培养hsc时,加入肝素酶,例如肝素酶i(heparinase i),或肝素酶及hdac抑制剂,例如vpa,可有效扩增hscs,并保持其干性。添加了肝素酶,例如肝
素酶i,或肝素酶及hdac抑制剂,例如vpa或saha的培养基组合物,在扩增lt-hsc细胞并维持其干性方面显著优于添加有sr1和/或um171等的细胞培养基的效果。因此,使用包含肝素酶,或包含肝素酶和vpa、saha等hdac抑制剂的组合物培养造血干细胞,可以显著扩增hsc,并更长时间维持其干性,有助于解决造血干细胞来源不足的问题。
附图说明
58.图1显示了目的细胞群cd34+/cd45+/cd45ra-/cd90+/cd38-细胞群的逻辑门及门位置的确定。
59.图2显示了在脐带血来源的cd34+细胞上进行化合物的最佳浓度以及能够维持hsc干性的筛选,表1中化合物(除saha-1μm或vpa-500μm外每种小分子测试3个浓度)诱导6-8天后流式检测lt-hsc细胞表面标志物(cd34+/cd45+/cd90+/cd45ra-/cd38-)表达分析图,横坐标代表抑制剂的名称以及使用浓度,纵坐标phsc扩增倍数代表实验组/mock组lt-hsc扩增的倍数。
60.图3显示了在脐带血来源的cd34+细胞上进行化合物维持hsc干性的最佳双分子组合的第一轮筛选,化合物组合(除vpa-500μm外,每个抑制剂测试3个浓度)诱导6天后流式检测lt-hsc细胞表面标志物(cd34+/cd45+/cd90+/cd45ra-/cd38-)表达分析图,横坐标代表抑制剂的名称以及使用浓度,纵坐标cd34+/cd45+/cd90+/cd45ra-/cd38-(%)代表lt-hsc占培养终末细胞总数的比例,cd45+cd34+(%)代表hsc纯度。
61.图4a-b显示了在脐带血来源的cd34+细胞上进行化合物维持hsc干性的最佳双分子组合的第二轮筛选,小分子组合(除vpa-500μm外,每个抑制剂测试3个浓度)诱导8天后流式检测lt-hsc细胞表面标志物(cd34+/cd45+/cd90+/cd45ra-/cd38-)表达分析图,横坐标代表抑制剂的名称以及使用浓度,图4a纵坐标cd34+/cd45+/cd90+/cd45ra-/cd38-(%)代表lt-hsc占培养终末细胞总数的比例,图4b纵坐标cd34+cd45+(%)代表hsc纯度。
62.图5a-b显示了在脐带血来源的cd34+细胞上进行化合物维持hsc干性的最佳双分子组合的第三轮筛选(与单独vpa进行比较),小分子组合诱导8天后流式检测lt-hsc细胞表面标志物(cd34+/cd45+/cd90+/cd45ra-/cd38-)表达分析图,横坐标代表抑制剂的名称以及使用浓度,纵坐标cd34+/cd45+/cd90+/cd45ra-/cd38-(%)代表lt-hsc占培养终末细胞总数的比例,cd34+cd45+(%)代表hsc纯度。
63.图6a-6d显示了在脐带血来源的cd34+细胞上进行小分子抑制剂维持hsc干性的vpa+heparinase i双分子组合(与已知报道的小分子sr1、um171进行比较),小分子组合诱导6-8天后流式检测lt-hsc细胞表面标志物(cd34+/cd45+/cd90+/cd45ra-/cd38-)表达分析图,横坐标代表抑制剂的名称以及使用浓度,纵坐标cd34+/cd90+(%),cd34+/cd90+/cd45ra-(%),cd34+/cd45+/cd90+/cd45ra-/cd38-(%)代表lt-hsc占培养终末细胞总数的比例,cd34+cd45+(%)代表hsc纯度。
64.注:在文献研究中,不同的研究人员采用不同的细胞表面标志物定义lt-hsc,如cd34+/cd90+、cd34+/cd90+/cd45ra-、cd34+/cd45+/cd90+/cd45ra-/cd38-都可用来定义lt-hsc,在本研究实施例中,列出了这3种表面标志物组合的比例,最终采用cd34+/cd45+/cd90+/cd45ra-/cd38-的比例进行实验结果分析。
65.图7a-b显示了在脐带血来源的cd34+细胞上进行已筛选小分子抑制剂与文献报道
小分子抑制剂sr1、um171体外克隆形成能力的分析图。bfu-e、cfu-e、cfu-gm、cfu-gemm代表红系、髓系、淋巴系等血液系统不同谱系的克隆。横坐标代表抑制剂组合名称,纵坐标colonies number代表总克隆数,colonies number ofgemm代表cfu-gemm克隆数量。每组3个重复,*代表具有显著性差异。
66.发明详述
67.造血干细胞(hsc)是一种存在于血液、骨髓、脐带血等组织中的原始细胞,可以自我更新,具有分化成多种功能细胞的潜能,并且可以经历程序性的细胞死亡或凋亡。这里造血干细胞具有的这种自我更新的能力以及分化成多种功能细胞的潜能在本文中被称为造血细胞的“干性”。正是由于这种干性,造血干细胞可以形成血液和免疫细胞,并且负责不断更新血液,或用于治疗多种疾病。
68.如今从骨髓、动员外周血、脐带血等组织中分离到的造血干细胞往往包括:长期造血干细胞(lt-hsc)、短期造血干细胞(st-hsc)、以及造血祖细胞。lt-hsc可终生保持自我更新和多谱系分化潜能,因此在一些情况下被称为真正的造血干细胞,也是hsc干性的主要来源。对于开发基于hsc的细胞疗法而言,最重要的是获得这些lt-hsc。然而,由于hsc在培养中的外观和行为类似于普通的白细胞,这使得它们很难通过形态学(大小和形状)进行识别。自二十世纪60年代以来,hsc基础研究的主要重点一直是鉴定和表征这些干细胞。即使在今天,科学家也必须依靠细胞表面蛋白来鉴定干细胞,而这些蛋白仅能粗略地充当白细胞的标志物。
69.对造血干细胞进行鉴定或分离一般都是采用多个不同的细胞表面标志物的组合。已知现在常用于鉴定人类lt-hsc的表面标志物表征包括:cd34-、cd38-、cd45ra-、sca-1+、cd90、c-kit+、lin-、cd135-、slamf1/cd150+等。其中cd34是最重要的标志之一,在造血干细胞及其祖细胞的分离和鉴定中,cd34分子是第一个被广泛研究的分子。cd34在人脐带血、骨髓和外周血中约0.1-4.9%的细胞上表达,在0.55%的人骨髓细胞上表达,在早期祖细胞上有表达,而在成熟的骨髓细胞上不表达。cd34往往用于与其他表面标记结合使用来区分原始细胞群体。在造血干细胞分离过程中,往往将cd34+的细胞群体认为是hsc。cd38又称环状adp核糖水解酶,是一种存在于许多免疫细胞(白细胞)表面的糖蛋白。cd38标记用于区分造血干细胞多能细胞(cd38-)和定向细胞(cd38+)。cd90,也被称为thy-1,是一个28-30kda的gpi连接膜糖蛋白。cd90表达于造血干细胞、神经元、胸腺细胞、外周t细胞、成纤维细胞和基质细胞。通常认为cd90+在cd34+cd38-上的共表达即可被用于定义造血干细胞,而cd34+cd38-cd90-则定义了多能祖细胞。cd45ra是原始t淋巴细胞的表面标志物,不应表达于造血干细胞表面。现已知报道的最原始的造血干细胞(hsc)/祖细胞(pc)群体的特征是cd34+、cd45+(cd45阳性)、cd90+(cd90阳性)、cd45ra-(cd45ra阴性)、cd38-(cd38阴性)(d wisniewski等,further phenotypic characterization of the primitive lineage-cd34+cd38-cd90+cd45ra-hematopoietic stem cell/progenitor cell sub-population isolated from cord blood,mobilized peripheral blood and patients with chronic myelogenous leukemia,2011,blood cancer j)。
70.不同的研究人员采用不同的细胞表面标志物定义lt-hsc,如cd34+/cd90+、cd34+/cd90+/cd45ra-、cd34+/cd45+/cd90+/cd45ra-/cd38-都可用来定义lt-hsc,在本技术中,采用cd34+/cd45+/cd90+/cd45ra-/cd38-定义lt-hsc。
71.本技术所述的造血干细胞(hsc)可以来源于骨髓细胞、外周血细胞(经过动员或非经过动员的)或脐带血细胞,可通过例如层析或磁珠等纯化分离cd34+(cd34阳性)的细胞群体,作为培养扩增造血干细胞的起始细胞。本文中所述的lt-hsc可通过其细胞表面标志物进行鉴定,所述细胞表面标志物表征同时包括:cd34+、cd45+、cd90+、cd45ra-、cd38-。造血干细胞,例如lt-hsc的扩增后的数量可以通过本领域常用的方法,例如流式细胞术,对具有特定细胞标志物的细胞进行计数来实现。
72.造血干细胞的“干性”是指造血干细胞自我更新以及分化成多种功能细胞的潜能。造血细胞的干性可以通过本领域常规试验方法,例如体外克隆(cfu)形成试验,测试培养中的细胞形成原始的和持久的细胞集落的能力,即hsc分化成多种功能细胞的潜能来进行。在本技术实施例中,采用了流式细胞术与cfu形成试验相结合的方法测试了本技术提供的用于扩增造血干细胞的培养基组合物(包含细胞培养基以及肝素酶或肝素酶和vpa的组合(作为细胞培养添加剂))对hsc扩增及干性保持作用的影响,并从中证明本技术的用于扩增造血干细胞的培养基组合物促进造血干细胞扩增和保持其干性的作用。本技术的用于扩增造血干细胞的培养基组合物培养造血干细胞(例如来源于脐带血,外周血或骨髓)一定时间后(例如6-21天,6-18天,6-16天,6-15天,6-14天,6-13天,6-12天,6-11天,6-10天,6-9天,6-8天后),hsc数量,尤其是lt-hsc数量得到扩增,并且所述造血干细胞干性仍然保持。经过培养后,cd34+cd45+cd90+cd45ra-cd38-的数量可扩增1-15、2-15、3-15、4-15、5-15、6-15、7-15、8-15、9-15、10-15、11-15、12-15、13-15、14-15倍。
73.组合物
74.本技术提供了一种用于扩增造血干细胞和/或延长其干性保持时间的组合物,包含细胞培养基及肝素酶。
75.本文所述的细胞培养基,是指本领域技术人员所知晓的任意适宜于细胞体外生长和增殖,尤其是造血干细胞体外生长和增殖的培养基。本技术的细胞培养基包括任何商购的细胞培养基,例如购自stem cell techonologies的stemspantmsfem ii、购自thermo fisher的imdm、df12、knockout dmem、rpmi 1640、alpha mem、dmem等的商业化培养基。也可以是在此基础上添加了一种或多种本领域已知的有助于造血干细胞生长、增殖的化合物(例如细胞因子,激素、动物血清,例如小牛血清、造血干细胞表面表达蛋白的配体蛋白)的培养基。
76.本技术所述的“细胞培养基”是指在培养细胞过程中供给细胞营养、培养细胞生长和繁殖的溶液。细胞培养基中可含有氨基酸(例如谷氨酰胺、l-谷氨酰胺、l-组氨酸、l-异亮氨酸、l-亮氨酸、l-赖氨酸、l-蛋氨酸、l-苯丙氨酸、l-苏氨酸、l-色氨酸、l-缬氨酸)、维生素(脂溶性维生素如:a、d、e、k;水溶性维生素如:b1、b2、b6、b12、泛酸、叶酸、生物素、c、烟酰胺等)、叶酸、生物素、碳水化合物(例如葡萄糖、核糖、脱氧核糖、丙酮酸钠和醋酸),无机离子(例如(例如钠、钾、镁、钙、磷等基本的无机离子)、胶原、胰岛素、生长激素和多种生长因子如表皮生长因子、成纤维细胞生长因子、增殖刺激因子(msa)、类胰岛素生长因子(igfl、igf2)等。细胞培养基中可含有动物血清(例如小牛血清或胎牛血清)或不含有动物血清。
77.本技术所述的“细胞因子”是指由细胞释放,充当细胞间化学信使调节另一细胞功能的作用的蛋白质,这些蛋白质在包括繁殖、生长、发育以及损伤修复等多种生理过程中影响细胞行为的变化,包括例如白介素,干扰素,集落刺激因子,肿瘤坏死因子和生长因子等。
78.本技术所述的细胞培养基优先适宜于造血干细胞体外培养的细胞培养基。该培养基可以商购,也可以自行配制,例如购买商购细胞培养基(例如stem cell techonologies的stemspantmsfem ii、购自thermo fisher的imdm、df12、knockout dmem、rpmi 1640、alpha mem、dmem)后,添加已知的有助于造血干细胞体外生长和增殖的一种或多种化合物,包括例如细胞因子,小分子化合物、造血干细胞表面表达蛋白的配体蛋白等。在一些实施方案中,所述细胞培养基是有助于造血干细胞体外培养的细胞培养基,例如在商购细胞培养基(例如stem cell techonologies的stemspantmsfem ii、购自thermo fisher的imdm、df12、knockout dmem、rpmi 1640、alphamem、或dmem)基础上,添加例如its(即主要包括胰岛素、人转铁蛋白以及硒元素)、l-谷氨酰胺、维生素c以及牛血清白蛋白等制备的细胞培养基。在一些实施方案中,所述细胞培养基含有血清。在一些实施方案中,所述细胞培养基不含有血清。此外,可以根据需要进一步在上述培养基中额外添加一些细胞营养成分。在一些实施方案中,所述细胞培养基包括上述df12、its、l-谷氨酰胺、维生素c和牛血清白蛋白;在一些实施方案中,所述细胞培养基包括knockout dmem、its、l-谷氨酰胺、维生素c和牛血清白蛋白;在一些实施方案中,所述细胞培养基包括rpmi 1640、its、l-谷氨酰胺、维生素c和牛血清白蛋白;在一些实施方案中,所述细胞培养基包括alpha mem可、its、l-谷氨酰胺、维生素c和牛血清白蛋白;在一些实施方案中,所述细胞培养基包括dmem、its、l-谷氨酰胺、维生素c和牛血清白蛋白;在此,各种细胞培养基中外加的its的浓度可以是:胰岛素浓度是0.1mg/ml、人转铁蛋白是0.0055mg/ml、硒元素6.7*10-6mg/ml,此外,外加的its各成分的浓度也可以根据实际需要来调整,its可以从thermofisher购买,并根据需要调节成合适的最终使用浓度。
79.造血干细胞培养中常用的细胞因子包括干细胞生长因子(scf)和促血小板生成素(tpo)(ogawa等,expression and function of c-kit in hemopoietic progenitor cells,j exp med.1991)。scf能够与白介素-3、白介素-6、白介素-11、白介素-12、白介素-27和tpo协同,共同调节造血干细胞的存活和增殖。tpo则是另一个关键的生长因子。研究表明,tpo在体外培养造血干细胞过程中,与scf连用可显著扩增造血干细胞(sitnicka,et al.blood.1996;kimura,et al.pnas.1998)。此外,转化生长因子-β(transforming growth factor-β1,tgf-β)能够维持造血干细胞自我更新至少一个星期(oshima,et al.dev biol.1996;larsson,et al.blood.2003)。除此之外,其它的细胞因子例如白介素-6(interleukin 6,il-6)、fms相关的酪氨酸激酶3受体(flt3l)、notch蛋白的配体等在hsc的体外培养中亦可发挥积极作用(zhao,et al.progress in hematology.2016)。
80.因此,在一些实施方案中,所述细胞培养基中包含的细胞因子可以选自包含以下细胞因子的一种或多种细胞因子:干细胞因子scf、flt-3l、g-csf、il-3、血管生成素样蛋白(angptl3)、tgf-β、notch配体、il-6、tpo等。根据专利申请cn2017111165069中的数据可知,在一些实施方案中,所述细胞培养基包含的基础培养基可以为stemspantmsfem ii(购自stem cell techonologies),包含的细胞因子为50-200ng/ml scf,50-200ng/ml flt3-l,10-100ng/ml il-6,50-200ng/ml tpo,50-200ng/ml tgf-β,10-100ng/ml notch配体。在一些实施方案中,所述细胞培养基包含stemspantmsfem ii(购自stem cell techonologies)、100ng/ml scf、100ng/ml flt3-l、20ng/ml il-6、100ng/ml tpo、50ng/ml tgf-β、50ng/ml notch配体。
81.已知一些信号通路的激活剂和抑制剂在维持和扩增hsc上有正向作用,例如wnt信号通路激活剂chir、mtor信号抑制剂rapamycin、ahr通路抑制剂sr1等。2014年,iman fares等发现um729/um171小分子能够实现对lt-hsc的体外扩增,并相对于sr1刺激等方法具有显著优势(iman fares等,cord blood expansion.pyrimidoindole derivatives are agonists of human hematopoietic stem cell self-renewal,2014,science)。此外,cn 201811118030.7还公开了一种扩增造血干细胞的方法,所述方法包括将包含造血干细胞的起始细胞与jnk信号通路抑制剂接触。结果显示jnk信号通路抑制剂,例如jnk-in-8、可敲低c-jun表达的shrna等均可实现lt-hsc的细胞群扩增。
82.因此,在一些实施方案中,本文所述细胞培养基包含的小分子化合物选自包含以下小分子的一种或多种化合物:ahr芳烃受体抑制剂stemregenin 1(sr1)、wnt信号通路激活剂chir、mtor信号抑制剂rapamycin、吲哚嘧啶衍生物um729、um171、jnk信号通路抑制剂等。在一些实施方案中,本文所述细胞培养基还可以包含以上所述通路的其他抑制剂,包括针对以上通路的shrna,sirna,rnai,抗体及配体等。在一些实施方案中,所述培养基包含的小分子化合物为20nmol/ml-1μmol/mlum171。在一些实施方案中,所述培养基包含的小分子化合物为350nmol/mlum171。
83.目前已有研究表明胆固醇代谢通路与造血干细胞的增殖息息相关。已知高胆固醇血症可加速造血干细胞的扩增和迁移,然而,其分子机理目前尚不明确。三磷酸腺苷结合蛋白abca1和abcg1通过把hscs内胆固醇转运至高密度脂蛋白(hdl)而将其运出细胞,而载脂蛋白e(apolipoprotein e,apoe)可通过影响abca1和abcg1的功能调节细胞内胆固醇流出。apoe是一种多态性蛋白,参与脂蛋白的转化与代谢过程,其基因可以调节许多生物学功能。apoe在hscs中表达丰富,apoe分泌到细胞表面后与肝素结合,体外研究时可通过肝素酶i(heparinase i)酶切肝素位点,去除细胞表面的apoe。本技术发现通过肝素酶去除hsc表面的apoe,可以促进hsc的扩增。例如本技术实施例5、6、8证明了使用本技术包含肝素酶i的细胞培养基组合物可显著扩增hsc群体及其中的lt-hsc,达到了对hsc的扩增及干性保持的目的。而如图6所示,使用含有肝素酶的组合物(肝素酶i+vpa)培养造血干细胞对hsc群体的扩增与um171相当,而对hsc中lt-hsc的扩增则达到了使用含sr1或um171的细胞通路抑制剂的7~15倍。并且,如图7a所示,在细胞集落形成能力方面,单加肝素酶i和vpa+肝素酶i组合是单加vpa、sr1、um171组的1.5倍左右;而如图7b所示,在cfu-gemm集落形成能力方面,vpa+肝素酶i组合是单加vpa的10倍左右,是单加um171的7倍左右,是单加肝素酶i的1.5倍左右,且具有显著性差异。
84.本技术提供的用于扩增造血干细胞和/或延长其干性保持时间的组合物中所含有的肝素酶是一类作用于肝素或者乙酰肝素分子的多糖裂解酶,包括微生物产生的以裂解方式降解肝素或硫酸乙酰肝素的酶类,以及动物体内产生的以水解方式降解硫酸乙酰肝素的内源性(类)肝素酶。其中,所述肝素是一种高度硫酸化的多分散线性糖胺聚糖类化合物,主要由糖醛酸(艾杜糖醛酸,idoa,约占90%)和d葡萄糖氨(glcn)通过α(1-4)糖苷键组成的三硫酸二糖单元重复共聚形成。本技术所述的肝素酶可以从一些利用肝素为碳源的细菌中分离得到,例如可以从肝素黄杆菌(flavobacterium heparinum或pedobacter heparinus)中分离得到。此外,在许多微生物中也发现了肝素酶的存在,如棒杆菌(corynebacterium sp.)、鞘胺醇杆菌(sphingobacterium sp.)、枯草芽孢杆菌(bacillus subtilis)、环状芽
孢杆菌(bacillus circulans)、解肝素拟杆菌(prevotella heparinolytica)以及粪便拟杆菌(bacteroides stercoris hj-15)等。因此,本技术所述的肝素酶也可以从这些微生物中分离获得。目前,已从肝素黄杆菌中分离纯化出的肝素酶有三种,分别为肝素酶i、ii、iii,这三种酶的底物特异性程度各不相同,而其中肝素酶i最适用于低分子量肝素的制备(马小来等,肝素黄杆菌肝素酶i的纯化,2005,食品与药品)。因此,在一些具体实施方案中,本技术提供的用于扩增造血干细胞和/或延长其干性保持时间的组合物中包含的肝素酶为肝素酶i。所述肝素酶i可切断肝素和硫酸乙酰肝素硫酸化的二糖glcns(6s)-idoua(2s)连接键,终产物主要是二糖。
85.在本技术中,所述肝素酶,例如肝素酶i的使用量以酶活力单位(u)表示。本文中的1u即一个酶活力单位,是指在ph 7.5、温度25℃条件下,每小时形成0.1μm不饱和糖醛酸所需的酶量,一个国际单位(iu)相当于约600u。
86.在一些实施方案中,所述用于扩增造血干细胞和/或延长其干性保持时间的组合物还进一步包括hdac(组蛋白去乙酰化酶)抑制剂,即所述用于扩增造血干细胞和/或延长其干性保持时间的组合物包含肝素及hdac抑制剂。本文所述hdac是一种可将赖氨酸残基上的乙酰基去除的酶,通过去除组蛋白赖氨酸残基上的乙酰基,hdac可以使dna更紧地缠绕在组蛋白上,从而导致这些dna不易被基因转录因子接触,结果导致与细胞分化、细胞周期阻滞等有关的蛋白的表达受到抑制。而hdac抑制剂则可干扰hdac的去乙酰化作用,抑制hdac,使dna对组蛋白的缠绕放松,与细胞分化、细胞周期组织等有关的蛋白的表达。已知的hdac抑制剂包括:异羟肟酸类、羧酸类、苯甲酰胺类、亲电酮类、环肽类等。其中,异羟肟酸类hdac抑制剂包括tsa、saha、cbha、laq-824、pxd101、pyroxamide等;羧酸类hdac抑制剂包括丙戊酸(vpa)、丁酸钠、本基丁酸化合物an29等;苯甲酰胺类hdac抑制剂包括ms-275、ci-994等;亲电酮类hdac抑制剂包括三氟甲基酮、α-酮酰胺等;环肽类包括fk228等(谭玉梅,组蛋白去乙酰化酶抑制剂研究进展,2009,药学学报)。本技术实施例5和6证明了肝素酶i与hdac抑制剂组合对hsc扩增及干性保持积极作用。如图3所示,saha、vpa等hdac抑制剂均能显著增加hsc中lt-hsc的比例。图4和图6则显示了以vpa为代表的hdac抑制剂与肝素酶i的组合对hsc群体的扩增,尤其是对lt-hsc比率的提升作用显著优于um171等常用的hsc刺激剂,并且优于vpa与atorvastatin(阿托伐他汀)、lovastatin(洛伐他汀)等胆固醇合成途径中的限速酶hmg-coa的抑制剂的组合。
87.在一些实施方案中,所述hdac抑制剂为vpa。在一些实施方案中,所述hdac抑制剂为为saha。在一些实施方案中,所述vpa的浓度选自:5μm-1mm、100μm-900μm、200μm-800μm、300μm-700μm、400μm-600μm、450μm-550μm。
88.试剂盒及添加剂
89.本技术还提供了一种用于扩增造血干细胞和/或延长其干性保持时间的试剂盒,包含如前所述的用于扩增造血干细胞和/或延长其干性保持时间的组合物。在一些实施方案中,所述试剂盒中来自所述组合物的不同成分分别存在于试剂盒中的不同容器中。在一些实施方案中,所述试剂盒中来自所述组合物中的两种或多种成分以一定的比例混合在同一容器中。在一些实施方案中,所述细胞培养基与肝素酶分别存在于所述试剂盒中的不同容器中。在一些实施方案中,所述试剂盒还进一步包含对其中各种成分的使用说明,以指导使用者在使用所述试剂盒时可以将各种成分按前述适于hsc扩增及干性保持的比例配置成
本技术所述组合物,例如使得vpa的浓度为约:5μm-1mm、100μm-900μm、200μm-800μm、300μm-700μm、400μm-600μm、450μm-550μm,并且肝素酶i的浓度为约:0.5u~10u、1~9u/ml、1.5~8.5u/ml、2~8u/ml、2.5~7.5u/ml、3~7u/ml、3.5~6.5u/ml、4~6u/ml、4.5~5.5u/ml。
90.本技术还提供了一种用于扩增造血干细胞和/或延长其干性保持时间的细胞培养基添加剂组合,包括肝素酶i及vpa。在一些实施方案中,vpa的浓度为约:5μm-1mm、100μm-900μm、200μm-800μm、300μm-700μm、400μm-600μm、450μm-550μm,并且肝素酶i的浓度为约:0.5u~10u、1~9u/ml、1.5~8.5u/ml、2~8u/ml、2.5~7.5u/ml、3~7u/ml、3.5~6.5u/ml、4~6u/ml、4.5~5.5u/ml。
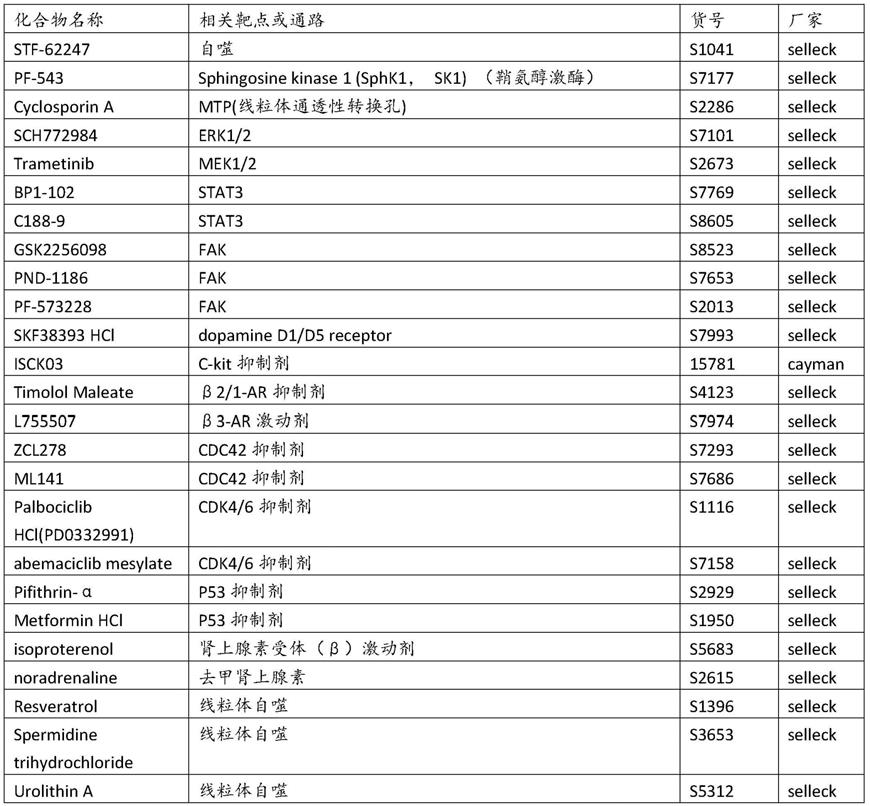
91.造血干细胞培养方法
92.本技术还提供了一种用于扩增造血干细胞和/或延长其干性保持时间的方法,其包含使用如前所述的用于扩增造血干细胞和/或延长其干性保持时间的组合物培养造血干细胞。在一些实施方案中,使用本技术所述组合物培养所述造血干细胞合适的时间,例如6-20天,6-18天,6-16天,6-15天,6-14天,6-13天,6-12天,6-11天,6-10天,6-9天,6-8天。
93.疾病治疗方法及干细胞
94.目前,已有研究证明um171可刺激hsc中lt-hsc绝对值的显著增加,并且经其刺激在体外扩增的人脐带血细胞可以在免疫缺陷的小鼠体内重建人造血系统至少6个月,2019年11月,sandra cohen等又在临床上进一步证明了um171对干细胞的扩增是可行且安全的(sanatra cohen等,hematopoietic stem cell transplantation using single um171-expanded cord blood:a single-arm,phase 1
–
2safety and feasibility study,2019,lancet haematology)。以上结论说明经体外刺激培养的造血干细胞,在lt-hsc保持较高比例的情况下,可成功应用于临床。因此,发明人在实施例中对比了本技术中所述组合物相较于um171对造血干细胞,尤其是lt-hsc的作用。结果如图6所示,使用含有肝素酶的组合物(肝素酶i+vpa)培养造血干细胞对hsc群体的扩增与um171相当,而对hsc中lt-hsc的扩增则达到了使用含sr1或um171的细胞通路抑制剂的7~15倍。如图7所示,是对经扩增的hsc干性中分化潜能的进一步测试,结果显示在提高细胞集落形成,尤其是具有干性的细胞集落(cfu-gemm)形成方面,双分子组合vpa+肝素酶i效果优于小分子vpa、um171、sr1、肝素酶i的单独使用,单独肝素酶i的单独使用也显著优于单加vpa、sr1、及um171。因此,本技术还提供了一种用于疾病治疗的方法,包括将经过前述用于扩增造血干细胞和/或延长其干性保持时间的方法培养的造血干细胞移植入患者体内,用于疾病的治疗。保有足够干性的造血干细胞可用于造血干细胞移植相关适应症,包括移植物抗宿主病、自身免疫病或造血系统病症。因此,在一些实施方案中,所述疾病包括选自以下的任一种:移植物抗宿主病、自身免疫病或造血系统病症。在一些实施方案中,所述疾病选自包括以下任一种的自身免疫病:类风湿性关节炎、系统性红斑狼疮、多发性硬化症、i型糖尿病、系统性硬化症等;在一些实施方案中,所述疾病选自包括以下任一种的造血系统病症:急性髓性白血病、急性淋巴细胞白血病、慢性髓性白血病、慢性淋巴细胞白血病、骨髓增殖性疾病、骨髓增生异常综合征、多发性骨髓瘤、非霍奇金淋巴瘤、霍奇金病、再生障碍性贫血、单纯红细胞再生障碍、阵发性睡眠性血红蛋白尿症、珠蛋白生成障碍性贫血、镰状细胞性贫血、重症联合免疫缺陷、嗜血细胞性淋巴组织细胞增生和先天性代谢缺陷等。在一些实施方案中,所述疾病可以是因病毒感染而引起的血液系统或免疫系统疾病,例如艾滋病等。
95.同时,本技术还提供了一种造血干细胞,所述造血干细胞为从骨髓、外周血、脐带血、胎儿造血系统或胚胎干细胞等获得的造血干细胞,经前述用于扩增造血干细胞和/或延长其干性保持时间的组合物培养后获得的造血干细胞。所述造血干细胞的应用包括用于上述疾病治疗的方法。本技术还涉及包含上述经培养的造血干细胞组合物或造血干细胞培养物,其中lt-hsc占培养终末细胞的3%~50%,或50%以上。
实施例
96.实施例1:脐带血分选cd34+hsc用于后续小分子筛选
97.准备试剂h-lyse buffer(1
×
)溶液和wash buffer(1
×
)溶液。取5ml h-lyse buffer 10
×
储存液(r&d,货号:wl1000),加45ml去离子水(0.22μm滤膜过滤),混匀,配制成h-lyse buffer(1
×
)溶液。取5ml wash buffer 10
×
储存液(r&d,货号:wl1000),加45ml去离子水,混匀,配制成wash buffer(1
×
)溶液。
98.向10ml新鲜人脐带血中加注生理盐水至终体积为30ml。向该稀释血液中加入人淋巴细胞分离液(达科为,货号:dkw-klsh-0100),之后400g离心30min(设置升速3,降速0),吸取白膜层,500g离心10min。将细胞沉淀集中至一个50ml离心管中,加入h-lyse buffer(1
×
)10ml,常温裂解红细胞10min。然后加入10ml wash buffer(1
×
)终止裂解反应,补加生理盐水至终体积为50ml。将上述50ml离心管转移至高速离心机中,500g离心10min,弃上清,用50ml生理盐水(1%hsa,人血清蛋白)重悬细胞,混匀,取20μl细胞悬液至细胞计数仪(nexcelom,型号:cellometerk2)中计数,将该离心管转移至高速离心机中,500g离心10min。弃上清,根据计数结果加入相应体积的磁珠(100μl fcr/1*10^8cell和100μl cd34 microbeads/1*10^8cell),首先加入fcrblocking reagent(miltenyi biotec,货号:130-100-453,试剂用量根据细胞计数结果决定)重悬细胞,再加入预混匀的cd34 microbeads(cd34microbead kit ultrapure,human:miltenyibiotec,货号:130-100-453),混匀,4℃冰箱中孵育30min。往离心管中加生理盐水(1%hsa)至终体积为50ml,转移至高速离心机中,500g离心10min。准备磁力分离器(miltenyibiotec,型号:130-042-102)和一个磁力架(miltenyibiotec,型号:130-042-303),将磁力分离器调整至合适高度,放入ms column(miltenyibiotec,货号:130-042-201)或ls column(miltenyibiotec,货号:130-042-401)(根据细胞量决定选用柱子的类型,具体参考产品相关说明书),下方放置15ml离心管(corning,货号:430791)收集非目标细胞悬液,用1ml(ms柱)或者3ml(ls柱)生理盐水(1%hsa)润洗ms column或ls column。待上述高速离心机(thermo,型号:st40)中的离心管离心后,弃上清,用1ml(ms柱)或3ml(ls柱)生理盐水(1%hsa)重悬细胞,往每个分选柱(分选柱的用量根据脐血的份数以及细胞量决定)中加入细胞悬液。再用1ml(ms柱)或3ml(ls柱)生理盐水(1%hsa)洗涤离心管,洗涤液加入柱中。
99.用1ml(ms柱)或3ml(ls柱)生理盐水(1%hsa)洗涤ms column或ls column。重复3次。将分选柱转移至新的15ml离心管上方,加入2ml(ms柱)或3ml(ls柱)生理盐水(1%hsa)洗脱目标细胞,再加入1ml(ms柱)或2ml(ls柱)生理盐水(1%hsa)重复洗脱目标细胞一次。取20μl细胞悬液至细胞计数仪(nexcelom,型号:cellometerk2)中计数,剩余细胞悬液400g离心5min。不完全弃上清,留1ml上清,重悬细胞。取一个新的ms column,加入1ml生理盐水(1%hsa)润洗,将上述经重悬的细胞的细胞悬液转移至该ms column中,重复上述洗涤和洗
脱步骤,获得3ml目标细胞悬液。取20μl细胞悬液至细胞计数仪(nexcelom,型号:cellometer k2)中计数,根据细胞密度和细胞悬液体积,计算总细胞数,剩余细胞悬液400g离心5min,弃上清备用。
100.实施例2:hsc细胞的培养与准备
101.根据化合物的说明书标明的溶解度以及所需溶剂(化合物货号参见表1),进行母液的配置,并根据设置的浓度梯度配制如下的培养基:sfemii培养基(stem cell,货号:09655)+50ng/ml flt-3l(peprotech,货号:300-100ug)+50ng/ml scf(peprotech,货号:300-07-100ug)+50ng/ml tpo(peprotech,货号:300-18-100ug)+10ng/ml il-6(peprotech,货号:200-06-20ug)+1%青链霉素双抗(hyclone,货号:sv30010)。
102.首先,将准备好的培养基加入到24孔板(corning,货号:3473)中,每孔950μl,放置在二氧化碳培养箱(thermo,型号:3111)中预热;将实施例1中备用的hsc用sfemii+50ng/ml flt-3l+50ng/ml scf+50ng/ml tpo+10ng/ml il-6+1%双抗重悬,按照每孔50μl细胞悬液,每孔细胞密度为2*10^5/ml计算所加的培养基体积和所需细胞量;从培养箱中拿出预热好的培养基,每孔中加入50μl细胞悬液,混匀后,显微镜(olympus,型号:ckx53)下观察细胞状态,然后放入培养箱中培养。
103.表1:化合物情况列表
104.[0105][0106][0107]
实施例3:流式检测hsc干性的检测方法的建立
[0108]
本实施例中所使用的抗体及其来源参见表2。
[0109]
表2:抗体
[0110][0111]
将上述实施例2中培养至6-8天(d6-d8)的细胞取样20μl计数,根据计数结果取出2*10^5个细胞的悬液至1.5ml离心管中;400g,5min离心,弃上清。取含1%hsa(人血清白蛋白,广东双林,货号:s10970069)的pbs(磷酸缓冲盐溶液,hyclone,货号:sh30256.01)100μl,重悬细胞,涡旋混匀,备用。然后,按照同待测样本细胞相同的方法收集经相同条件培养,但未经化合物处理的细胞,分为4组,包括:阴性对照(nc)组、同型对照(iso)组、apc荧光扣除对照(fmo38)组、pe荧光扣除对照(fmo90)组。以上4组细胞同待测样本细胞分别按如下表3所示组别的处理方式加入抗体,用于流式细胞术检测。
[0112]
同批次实验中各对照组不设重复检测。
[0113]
表3:流式检测组别设置
[0114]
[0115][0116]
按照上表3,向上述各组细胞的细胞悬液中,按组别对应加入抗体。涡旋混匀,室温避光孵育15min。15min孵育结束后,在每个待测细胞样本及对照样本中加入含1%hsa的pbs 1ml,混匀,400g,5min室温离心。离心结束后,弃上清,每个实验样本用100μl含1%hsa的pbs重悬细胞。上机检测前样本室温避光保存。使用流式细胞仪(贝克曼,型号:cytoflex)检测。
[0117]
检测结果按如下方法分析:1)目的细胞群为表面标志物为cd34+/cd45+/cd45ra-/cd90+/cd38-的细胞群,即长期造血干细胞细胞群;2)逻辑门及门位置的确定参见图1所示:首先圈定细胞群,p1门;来源于p1门的细胞群去除粘连细胞,为p2门;来源于p2门的细胞群用nc或iso圈定cd34,cd45,cd45ra阴性细胞群,为q3-ll门(cd34-/cd45-),q5-ul+q5-ll门(cd45ra-);fmo90圈定cd90阴性细胞群,为q5-ll+q5-lr门;fmo38圈定cd38阴性细胞群,为q6-lr门;应用nc,iso,fmo90和fmo38划定的门,确定q3-ur—q5-ul—q6-lr门圈定的细胞为目的细胞:长期造血干细胞。
[0118]
在本研究实施例中(图6),列出了经不同处理后这3种表面标志物组合的比例。其他相关实施例中均采用了cd34+/cd45+/cd90+/cd45ra-/cd38-的比例进行结果统计及分析。
[0119]
实施例4:单分子筛选
[0120]
使用实施例1中所示的方法分选脐带血来源的cd34+细胞,以实施例2相同的细胞培养方法进行能够维持hsc干性的化合物抑制剂的筛选,化合物诱导6-8天后,用与实施例3相同的方法使用流式细胞仪检测长期造血干细胞(long-term hematopoietic stem cell,lt-hsc)细胞表面标志物(cd34+/cd45+/cd90+/cd45 ra-/cd38-)表达。
[0121]
在本实施例中共进行了55个后选化合物的筛选(见表1),化合物浓度设置在1nm-1000μm之间,每个化合物测试3个浓度。
[0122]
图2结果表明,虚线以上的点所代表的抑制剂能够很好的维持hsc的干性,是阴性对照组mock(黑色圆形)的3倍以上。虚线以上深色正方形标识代表不同批次实验中的阳性对照(saha和vpa),黑色三角形标识代表阿托伐他汀(atorvastatin),黑色五星标识代表肝素酶i。灰色标识所代表的抑制剂维持干细胞干性的比例虽然较好,但在显微镜下观察细胞
受到明显增殖抑制,对细胞毒性大,故后续不对其做进一步研究。
[0123]
综上所述:在本实施例中,共筛选出能够维持lt-hsc干性的化合物共2个,是以肝素为靶点的肝素酶i(heparinase i)和以胆固醇合成途径中限速酶hmg-coa为靶点的抑制剂atorvastatin。
[0124]
实施例5:双分子组合筛选
[0125]
在实施例1中分选出来的脐带血来源的cd34+细胞上,以实施例2相同的细胞培养方法进行化合物维持hsc干性的最佳双分子组合筛选(见表4),双分子组合诱导6-8天(d6-d8)后,用与实施例3相同的方法使用流式细胞仪检测lt-hsc细胞表面标志物(cd34+/cd45+/cd90+/cd45ra-/cd38-)的表达。
[0126]
根据筛选的结果(见图3),能够显著维持hsc干性的小分子包括saha和vpa,从图中可知在维持lt-hsc干性方面,vpa(valproic acid,丙戊酸)效果好于saha,因此将vpa与其他抑制剂进行组合,具体结果见附图4和附图5。
[0127]
图4结果表明,在提高lt-hsc比例方面,vpa+atorvastatin(50μm)组合是单加vpa组的2倍,vpa+肝素酶i(5u)是单加vpa组的4倍左右,显著提高lt-hsc的比例。在维持cd34+细胞比例方面,vpa+atorvastatin(50μm)以及vpa+肝素酶i(5u)比单加vpa提高20%左右。由于在显微镜下观察到vpa+atorvastatin(50μm)组细胞增殖受到明显抑制,对细胞毒性较大,后续不做进一步检测。
[0128]
进一步验证胆固醇合成途径中限速酶hmg-coa的其它抑制剂:lovastatin(洛伐他汀)、aicar、thiamet、rosuvastatin(罗素伐他汀)与vpa组合后的效果,在本实施例中检测了同靶点的不同抑制剂与vpa的组合,图5结果表明,在提高lt-hsc比例方面,上述hmg-coa的其它抑制剂与vpa组合后的抑制效果未显著好于单独vpa组,在维持cd34+细胞比例方面,上述hmg-coa的其它抑制剂与vpa组合后与单加vpa无明显差异,故后续不做进一步检测。
[0129]
综上所述:经过本实施例的筛选,发现能够维持lt-hsc干性和cd34+细胞高比例的分子组合包括以hdac(组蛋白去乙酰化酶)为靶点的vpa以及以肝素为靶点的肝素酶i进行的组合vpa+肝素酶i。
[0130]
表4:双分子组合筛选
[0131][0132]
实施例6:肝素酶i与公开文献报道的小分子化合物um171,sr1单独使用和组合使用的比较
[0133]
在实施例1中分选出来的脐带血来源的cd34+细胞上,以实施例2相同的方法进行抑制剂肝素酶i与文献(fares i,et al.science.2014;boitano a e,et al.science.2010)报道的抑制剂um171、sr1单独使用和组合使用的比较。使用所述抑制剂诱导6-8天后,用与实施例3相同的方法使用流式细胞仪检测lt-hsc细胞表面标志物(cd34+/cd45+/cd90+/cd45ra-/cd38-)的表达。
[0134]
图6结果表明,在提高lt-hsc比例方面,vpa+肝素酶i(5u)是单加vpa组的2倍左右,是sr1、um171的15倍左右,显著提高lt-hsc的比例。在维持cd34+细胞比例方面,vpa+肝素酶i(5u)比单加vpa提高15%左右,比单加sr1高7%,比单加um171高35%,且具有显著性差异。
[0135]
综上所述,在维持lt-hsc干性方面和cd34+细胞比例方面,双分子组合vpa+肝素酶i效果优于小分子vpa、um171、sr1、肝素酶i的单独使用。
[0136]
实施例7:cd34+造血干细胞集落形成培养
[0137]
本实施例通过集落形成单位(colony-forming unit,cfu)对经过抑制剂诱导后的脐血来源的造血干细胞进行体外功能的定性和定量检测,验证其体外分化潜能。
[0138]
首先,分装100ml培养基。在2-8℃过夜解冻100ml methoculttmh4034optimum(stem cell,货号:04034)。剧烈摇晃1-2min后静置10min,待气泡浮升至液面。将50ml注射器针头紧套在5ml一次性注射器上,吸取1ml培养基,然后全部推出注射器以排尽注射器内气体,再重新吸取3ml培养基分装至每个15ml离心管(corning,货号:430791)。2-8℃保存1个月,-20℃长期保存,切勿反复冻融。
[0139]
准备3ml methoculttmh4034 optimum培养基,在室温(15-25℃)或2-8℃过夜解冻。
[0140]
进行细胞接种。取经抑制剂诱导后扩增培养7天后的细胞(脐血来源的cd34+造血干细胞)悬液做细胞计数,根据计数结果吸取100倍单孔细胞所需量的细胞悬液(例如,接种密度100个细胞/孔/3ml,应取10000个细胞),加入到1ml的2%fbs(gibco,货号:16000-044)-imdm(gibco,货号:12440-053)培养基中,混匀备用。将上述细胞混匀后吸取50μl细胞悬液加入到0.5ml imdm(2%fbs)重悬细胞(相当于将细胞悬液稀释10倍),混匀后,取出100μl细胞悬液(100个细胞)加入到3mlmethoculttmh4034 optimum中。涡旋至少4s后静置10min,待气泡浮升至液面。3cc注射器(stem cell,货号:28240)与钝头针16gauge(stemcell,货号:28110)配合使用,吸取所得细胞悬液1ml,全部推出注射器以排尽注射器内气体,重新吸取所得全部细胞悬液,向smsrtdishtm-6(stem cell,货号:27370,6孔板)一个孔注入3ml,缓慢倾斜6孔板使细胞悬液均匀铺满孔底部。按上述接种完所有细胞后,将6孔板各孔间隙内补加无菌pbs 3ml,防止培养基干涸。将6孔板盖好盖子后放入二氧化碳培养箱(thermo,型号:3111),在37℃,5%co2,95%相对湿度的条件下培养14天。
[0141]
于培养第7天和第14天观察集落,培养14天后用stemgridtm-6计数网格(stem cell,货号:27000)进行克隆计数。集落的判定标准如下:
[0142]
cfu-gemm(cfu-g、cfu-e、cfu-mm):粒细胞-红细胞-巨噬细胞-巨核细胞集落形成单位。一个集落内包含红细胞和20个或更多个非红细胞(粒细胞、巨噬细胞和/或巨核细胞),通常集落中心有红细胞,周围有非红细胞,非红细胞也可以集中在红细胞的一侧。cfu-gemm的集落通常比cfu-gm或bfu-e的集落大。在大多数细胞样本中比较少见(通常占集落总数的10%)。
[0143]
cfu-gm:含有超过20个以上粒细胞(cfu-g)和/或巨噬细胞(cfu-m)的集落。不显现红色或棕色,集落内个体细胞通常可以区分,特别是在集落边缘,大的集落可能有一个或多个密集的暗核。该集落生长及分化不需要促红细胞生成素(epo)。
[0144]
bfu-e:爆发红细胞集落形成单位,形成单个或多个细胞簇组成的集落,每个集落包含》200个成熟红细胞。当细胞被血红蛋白化时呈现红色或棕色,难以区分每簇内的单个
细胞,bfu-e是更加不成熟的祖细胞,它的生长需要红细胞生成素(epo)和其他细胞因子,尤其是白介素3(il-3)和干细胞因子(scf),以促进其集落的最佳生长。
[0145]
cfu-e:红细胞集落形成单位,可形成1-2个包含有8-200个红细胞的细胞簇,当细胞被血红蛋白化时呈现红色或棕色,在集落内难区分单个细胞。cfu-e是成熟的红细胞系的祖细胞,需要促红细胞生成素(epo)促进其分化。
[0146]
实施例8:肝素酶i和公开文献报道的抑制剂um171,sr1单独使用和组合使用的体外克隆形成能力的比较
[0147]
在实施例1中分选出来的脐带血来源的cd34+细胞上进行抑制剂肝素酶i与文献报道抑制剂um171,sr1单独使用和组合使用的体外克隆形成能力的比较。使用抑制剂处理细胞,6天后,以实施例7相同的方法进行体外克隆(cfu)形成检测,接种细胞14天后统计克隆数目,并对cfu-gemm进行分析,bfu-e、cfu-e、cfu-gm、cfu-gemm分别代表红系、髓系、淋巴系等血液系统不同谱系的克隆。
[0148]
图7a结果表明,在细胞集落形成能力方面,单加肝素酶i和vpa+肝素酶i组合是单加vpa、sr1、um171组的1.5倍左右,肝素酶i和vpa+肝素酶i组合培养细胞后,显著提高细胞的集落形成能力。
[0149]
图7b结果表明,在cfu-gemm集落形成能力方面,vpa+肝素酶i组合是单加vpa的10倍左右,是单加um171的7倍左右,是单加肝素酶i的1.5倍左右,且具有显著性差异。vpa+肝素酶i组合培养细胞后,显著提高细胞的cfu-gemm集落形成能力。
[0150]
综上所述,在提高细胞集落形成,尤其是具有干性的细胞集落(cfu-gemm)形成方面,双分子组合vpa+肝素酶i效果优于小分子vpa、um171、sr1、肝素酶i的单独使用。
[0151]
工业实用性
[0152]
hsc移植在移植物抗宿主病、自身免疫病及造血系统疾病的治疗中有着巨大的潜力。然而hsc来源不足以及其在体外培养中的干性保持问题成为将其广泛应用于上述疾病治疗的阻碍,也大大提升了上述疾病治疗的成本。本技术提供的组合物、方法、及相关产品等可帮助解决以上问题,增加造血干细胞移植相关疗法的可及性,同时降低成本。
