1.本发明属于电学层析成像在脑部成像检测领域的应用,具体涉及一种基于电阻抗层析成像测量框架的中风位置分类方法。
背景技术:
2.中风是世界上致死率第二高的疾病。中风分为两种类型,即出血性中风和缺血性中风。对于患者来说,及时治疗中风对患者的治疗有很大的帮助,同时准确判断中风类型的不同也是至关重要的。例如,溶栓“破凝”药物是急性缺血性中风的一种治疗方法,然而它要求患者应在症状出现后的四个半小时内使用,当对出血性中风使用该药物时,不仅对治疗没有帮助,反而会使患者的病情加重甚至出现生命危险。在临床实践中,计算机断层扫描(computed tomography)和磁共振成像(magnetic resonance imaging)是标准的成像方法。但是ct具有放射性,核磁共振的价格是十分昂贵的。并且这两种方法都需要很长时间的计算处理。
3.电阻抗断层成像是一种新兴的可视化技术并且已经成功应用于监测工业过程。由于其安全性、廉价性、便携性和高时间分辨率的优点,电阻抗成像也在医学成像领域被广泛研究。在脑部电阻抗断层成像中,通过将安全电流注入附着在头皮上的电极,测量剩余电极上的电压,根据该电压恢复大脑区域内的电导率。在最近的研究中,已经提出了基于电阻抗成像数据的各种分类方法。与基于图像的方法不同,这种方法避免了图像重建中所需的逆问题的求解,因此结果更可靠。如:如b.mcdermott等人2018发布在plos one第13卷、第7期,文献编号为e0200469,题为
‘
使用具有电阻抗断层成像测量框架的svm分类器检测脑出血’(brain haemorrhage detection using a svm classifier with electrical impedance tomography measurement frames)。这些研究已经证明了基于电阻抗成像测量数据进行分类的潜力。应该注意的是,颅骨是一种高电阻介质,对电阻抗成像的检测有很大影响。然而,当使用svm检测出血时,没有考虑颅骨。eit的测量电压中包含了大量的空间分布信息,以及病变的电导率信息。因此,需要一种方法对中风的类型以及空间位置进行快速分类,以帮助医生更好的判断当前患者的情况以便患者得到及时有效的治疗。
技术实现要素:
4.本发明解决的技术问题是提供了一种基于电阻抗层析成像测量框架的中风位置分类方法,使用跳线连接的神经网络对经过处理的电阻抗层析成像的测量电压数据进行中风位置的预测和分类。
5.本发明为解决上述技术问题采用如下技术方案,一种基于电阻抗层析成像测量框架的中风位置分类方法,其特征在于具体步骤为:
6.步骤一:对人脑区域进行划分,做一垂直于前额中心至后枕中心连线的平面,将平面从前额中心向后枕中心平移,当平面到达两侧太阳穴时停止,此时平面扫过的脑部区域为λ1,继续向后枕中心平移平面,当平面到达两侧耳后时停止,此时平面扫过的脑部区域
为λ2,余下未扫过的脑部区域为λ3;
7.步骤二:对患者情况进行类型划分,最终可以划分为:健康、λ1出血、λ1缺血、λ2出血、λ2缺血、λ3出血、λ3缺血共7种情况;
8.步骤三:将大量已知病变或健康情况的患者设置为训练数据患者组,将16电极的eit采集系统的电极以前额中心为1号电极,逆时针等间隔的将16个电极放置在训练数据患者组第一位患者头部的同一水平面;
9.步骤四:采用相对模式的安全电流激励和相邻模式的电压检测。即首先以1号电极和9号电极为激励电极,检测电极对依次为2号-3号、3号-4号、4号-5号、5号-6号、6号-7号、7号-8号、10号-11号、11号-12号、12号-13号、13号-14号、14号-15号、15号-16号,共获得12个边界测量电压。将这些数据作为1组保存,然后以2号电极和10号电极为激励电极,3号-4号为首对检测电极按上述方法依次获取数据,直到16号电极和8号电极为激励电极时获取完成最后一组12个边界测量电压。总共可以获得16组边界电压测量数据,每组数据包含12个边界测量电压;
10.步骤五:数据扩充,为了提高神经网络分类性能,使输入神经网络的数据信息更多,对原先12*16的eit电压数据进行数据变换。取1号电极和9号电极为激励电极的第一组数据,将15号-16号和2号-3号两个电压进行线性插值,得到16号-1号、1号-2号两个扩充电压,同理对7号-8号、10号-11号两个电压进行线性插值,得到8号-9号、9号-10号两个扩充电压,最终将第一组电压数据扩充为1号-2号、2号-3号、3号-4号、4号-5号、5号-6号、6号-7号、7号-8号、8号-9号、9号-10号、10号-11号、11号-12号、12号-13号、13号-14号、14号-15号、15号-16号、16号-1号,共16个电压数据。然后取2号电极和10号电极为激励电极的第二组数据,进行类似的操作,以此类推,最终将eit电压数据变换为16*16的大小;
11.步骤六:判断是否所有训练数据患者组的患者均采集了数据,若是则进行步骤七,若否则返回步骤三对下一位患者进行数据采集;
12.步骤七:训练神经网络的搭建,神经网络的结构按顺序分别由跳线块一、跳线块一、跳线块二、跳线块一、跳线块二、跳线块一、全局平均池化层、全连接层组成。其中跳线块一的结构为:
13.(1)卷积块一,由依次顺序连接的卷积层、批归一化层、激活层组成。其中卷积层滤波器大小为3*3,步长为1。激活层采用relu函数激活。经过了卷积块一的输出被表示为:
[0014][0015]
其中
[0016][0017]
式中,y为卷积块一的输出,a为卷积块一的输入,w为卷积块一的权重矩阵,b为偏置,x、y分别为输入矩阵的行、列序号,m、n分别为输出矩阵的行、列序号,f(x)为relu函数,t为激活层输入变量;
[0018]
(2)卷积块二,由顺序连接的卷积层、批归一化层组成。其中卷积层滤波器大小为3*3,步长为1。
[0019]
(3)卷积块三,由一个滤波器大小为1*1,步长为1的卷积层构成,其输入为卷积块
一的输入a。
[0020]
(4)relu激活层,将跳线块一的卷积块二与卷积块三的输出相加并送入relu函数激活。
[0021]
跳线块二的结构为:
[0022]
(1)卷积块四,由依次顺序连接的卷积层、批归一化层、激活层组成。其中卷积层滤波器大小为3*3,步长为2。激活层采用relu函数激活。
[0023]
(2)卷积块二。
[0024]
(3)卷积块五,由一个滤波器大小为1*1,步长为2的卷积层构成,其输入为卷积块四的输入。
[0025]
(4)relu激活层,将跳线块二的卷积块二与卷积块五的输出相加并送入relu函数激活。
[0026]
全局平均池化层将最后的跳线块一的输出进行压缩提取,转变为列向量,送入全连接层。全连接层包含7个神经元作为输出分别对应步骤二的分类情况,该层的激活函数为softmax,因此该层的输出被写为:
[0027][0028]
式中,y为该层的输出,y为激活函数的输入;
[0029]
步骤八:训练参数设置,每层权重以及偏置参数在0-1之间随机赋值,将初始学习率设置为10-4
,随着训练次数的增加缓慢的下降到最小10-6
。由于输出为7种分类,损失函数的数学形式为:
[0030][0031]
式中,p为标签值,q为网络输出值,i为输出神经元的序号。优化器采用混合动量加权估计方法,即
[0032][0033]
其中
[0034][0035][0036]
式中,lr为学习率,sgd为一般动量中间变量值,rms为平方动量中间变量值,λ1、λ2为动量超参数,o为极小值10-8
;
[0037]
步骤九:神经网络训练,根据训练数据患者组的ct、mri等图像对患者数据进行相应分类并设定标签,将所有采集到的数据以及分类结果进行归一化后送入具有跳线连接的神经网络。经过神经网络得到初始输出,将初始输出通过步骤八所设置的损失函数计算误差,并通过反向传播的形式由优化器更新每一层的权重参数。随即进行下一次训练。直到所有数据完成训练,即完成了一轮训练。随后再次从第一组数据开始输入神经网络训练,共进行100轮,完成全部神经网络的训练,将此时的权重与偏置数据保存。
[0038]
步骤十:预测神经网络的搭建,预测神经网络的结构按顺序分别由跳线块一、跳线块一、跳线块二、跳线块一、跳线块二、跳线块一、全局平均池化层、全连接层组成。其中跳线块一的结构为:
[0039]
(1)卷积块一,由依次顺序连接的卷积层、批归一化层、激活层组成。其中卷积层滤波器大小为3*3,步长为1。激活层采用relu函数激活。
[0040]
(2)卷积块二,由顺序连接的卷积层、批归一化层组成。其中卷积层滤波器大小为3*3,步长为1。
[0041]
(3)卷积块三,由一个滤波器大小为1*1,步长为1的卷积层构成,其输入为卷积块一的输入a。
[0042]
(4)relu激活层,将跳线块一的卷积块二与卷积块三的输出相加并送入relu函数激活。
[0043]
跳线块二的结构为:
[0044]
(1)卷积块四,由依次顺序连接的卷积层、批归一化层、激活层组成。其中卷积层滤波器大小为3*3,步长为2。激活层采用relu函数激活。
[0045]
(2)卷积块二。
[0046]
(3)卷积块五,由一个滤波器大小为1*1,步长为2的卷积层构成,其输入为卷积块四的输入。
[0047]
(4)relu激活层,将跳线块二的卷积块四与卷积块五的输出相加并送入relu函数激活。
[0048]
全局平均池化层将最后的跳线块一的输出进行压缩提取,转变为列向量,送入全连接层。全连接层七个神经元的输出经过softmax函数激活,最终得到的七个输出即为当前数据对应于七种情况的概率大小。
[0049]
步骤十一:预测数据获取,将16电极的eit采集系统的电极以前额中心为1号电极,逆时针等间隔的将16个电极放置在待检测患者(非训练数据患者组的患者)头部的同一水平面。进行步骤四所述的相同方式的相对模式的安全电流激励和相邻模式的电压检测。进行步骤五所述的相同方式的数据扩充。最终获得待预测数据。
[0050]
步骤十二:数据预测,将步骤九所保存的数据设定为预测神经网络的权重与偏置。将待预测数据经过归一化后送入预测神经网络进行预测,从而获得7种情况对应的概率大小,选取概率最大的情况作为最终的预测结果。
[0051]
本发明与现有技术相比具有以下有益效果:本发明提出了一种基于电阻抗层析成像测量框架的中风位置分类方法,该方法通过使用电阻抗层析成像测量框架从大量患者中获取测量电压数据进行处理,然后将处理好的数据输入跳线连接的神经网络进行训练,训练完成后,将待预测的患者电压数据进行处理后输入训练完成的预测网络中即可以获得当前病变情况的预测结果。该方法可以快速诊断当前患者的疾病位置以及类型,较大的提高了患者治愈的可能。
附图说明
[0052]
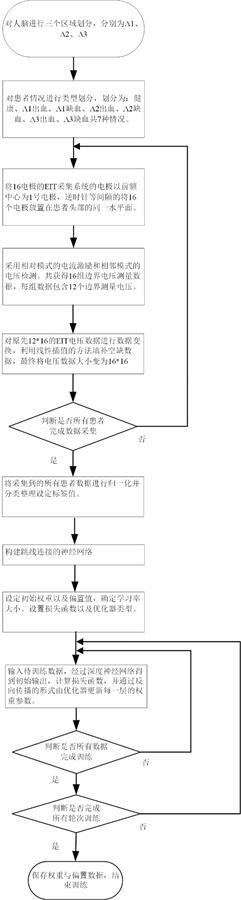
图1为本发明提供的一种基于电阻抗层析成像测量框架的中风位置分类方法的神经网络训练流程框图。
[0053]
图2为本发明提供的一种基于电阻抗层析成像测量框架的中风位置分类方法的神经网络预测流程框图。
[0054]
图3为本发明实施例中λ1、λ2、λ3区域的划分、电极排布、测量模式、激励模式。
[0055]
图4为本发明实施例中所构建的神经网络结构图。
[0056]
图5为对待预测数据加入信噪比为40db噪声时的预测结果。
[0057]
图6为对待预测数据加入信噪比为20db噪声时的预测结果。
[0058]
图7为对待预测数据加入信噪比为10db噪声时的预测结果。
[0059]
图中:a为电极,b为测量电压,c为等电势线,d为接地,e为激励电流,f为前额方向,g为后枕方向,h为λ1,i为λ2,j为λ3。
具体实施方式
[0060]
结合附图和实施例对本发明一种基于电阻抗层析成像测量框架的中风位置分类方法进行详细的说明。
[0061]
本文提出了一种基于电阻抗层析成像测量框架的中风位置分类方法,使用跳线连接的神经网络对经过处理的电阻抗层析成像的测量电压数据进行中风位置的预测和分类。实施步骤流程如图1及图2所示,具体实施步骤如下:
[0062]
步骤一:对人脑区域进行划分,做一垂直于前额中心至后枕中心连线的平面,将平面从前额中心向后枕中心平移,当平面到达两侧太阳穴时停止,此时平面扫过的脑部区域为λ1,继续向后枕中心平移平面,当平面到达两侧耳后时停止,此时平面扫过的脑部区域为λ2,余下未扫过的脑部区域为λ3。
[0063]
步骤二:对患者情况进行类型划分,最终可以划分为:健康、λ1出血、λ1缺血、λ2出血、λ2缺血、λ3出血、λ3缺血共7种情况。
[0064]
步骤三:将大量已知病变或健康情况的患者设置为训练数据患者组,将16电极的eit采集系统的电极以前额中心为1号电极,逆时针等间隔的将16个电极放置在训练数据患者组第一位患者头部的同一水平面。
[0065]
步骤四:采用相对模式的安全电流激励和相邻模式的电压检测。即首先以1号电极和9号电极为激励电极,检测电极对依次为2号-3号、3号-4号、4号-5号、5号-6号、6号-7号、7号-8号、10号-11号、11号-12号、12号-13号、13号-14号、14号-15号、15号-16号,共获得12个边界测量电压。将这些数据作为1组保存,然后以2号电极和10号电极为激励电极,3号-4号为首对检测电极按上述方法依次获取数据,直到16号电极和8号电极为激励电极时获取完成最后一组12个边界测量电压。总共可以获得16组边界电压测量数据,每组数据包含12个边界测量电压。图3展示了本发明具体实施例中的脑部区域划分、电极排布以及其中某一时刻的电极激励和测量模式。
[0066]
步骤五:数据扩充,为了提高神经网络分类性能,使输入神经网络的数据信息更多,对原先12*16的eit电压数据进行数据变换。取1号电极和9号电极为激励电极的第一组数据,将15号-16号和2号-3号两个电压进行线性插值,得到16号-1号、1号-2号两个扩充电压,同理对7号-8号、10号-11号两个电压进行线性插值,得到8号-9号、9号-10号两个扩充电压,最终将第一组电压数据扩充为1号-2号、2号-3号、3号-4号、4号-5号、5号-6号、6号-7号、7号-8号、8号-9号、9号-10号、10号-11号、11号-12号、12号-13号、13号-14号、14号-15号、15
号-16号、16号-1号,共16个电压数据。然后取2号电极和10号电极为激励电极的第二组数据,进行类似的操作,以此类推,最终将eit电压数据变换为16*16的大小。
[0067]
步骤六:判断是否所有训练数据患者组的患者均采集了数据,若是则进行步骤七,若否则返回步骤三对下一位患者进行数据采集。
[0068]
步骤七:训练神经网络的搭建,神经网络的结构如图4所示,按顺序分别由跳线块一、跳线块一、跳线块二、跳线块一、跳线块二、跳线块一、全局平均池化层、全连接层组成。其中跳线块一的结构为:
[0069]
(1)卷积块一,由依次顺序连接的卷积层、批归一化层、激活层组成。其中卷积层滤波器大小为3*3,步长为1。激活层采用relu函数激活。经过了卷积块一的输出可以被表示为:
[0070][0071]
其中
[0072][0073]
式中,y为卷积块一的输出,a为卷积块一的输入,w为卷积块一的权重矩阵,b为偏置,x、y分别为输入矩阵的行、列序号,m、n分别为输出矩阵的行、列序号,f(x)为relu函数,t为激活层输入变量。
[0074]
(2)卷积块二,由顺序连接的卷积层、批归一化层组成。其中卷积层滤波器大小为3*3,步长为1。
[0075]
(3)卷积块三,由一个滤波器大小为1*1,步长为1的卷积层构成,其输入为卷积块一的输入a。
[0076]
(4)relu激活层,将跳线块一的卷积块二与卷积块三的输出相加并送入relu函数激活。
[0077]
跳线块二的结构为:
[0078]
(1)卷积块四,由依次顺序连接的卷积层、批归一化层、激活层组成。其中卷积层滤波器大小为3*3,步长为2。激活层采用relu函数激活。
[0079]
(2)卷积块二。
[0080]
(3)卷积块五,由一个滤波器大小为1*1,步长为2的卷积层构成,其输入为卷积块四的输入。
[0081]
(4)relu激活层,将跳线块二的卷积块二与卷积块五的输出相加并送入relu函数激活。
[0082]
全局平均池化层将最后的跳线块一的输出进行压缩提取,转变为列向量,送入全连接层。全连接层包含7个神经元作为输出分别对应步骤二的分类情况,该层的激活函数为softmax,因此该层的输出可以被写为:
[0083][0084]
式中,y为该层的输出,y为激活函数的输入。
[0085]
步骤八:训练参数设置,每层权重以及偏置参数在0-1之间随机赋值,将初始学习率设置为10-4
,随着训练次数的增加缓慢的下降到最小10-6
。由于输出为7种分类,损失函数的数学形式为:
[0086][0087]
式中,p为标签值,q为网络输出值,i为输出神经元的序号。优化器采用混合动量加权估计方法,即
[0088][0089]
其中
[0090][0091][0092]
式中,lr为学习率,sgd为一般动量中间变量值,rms为平方动量中间变量值,λ1、λ2为动量超参数,o为极小值10-8
。
[0093]
步骤九:神经网络训练,根据训练数据患者组的ct、mri等图像对患者数据进行相应分类并设定标签,将所有采集到的数据以及分类结果进行归一化后送入具有跳线连接的神经网络。经过神经网络得到初始输出,将初始输出通过步骤八所设置的损失函数计算误差,并通过反向传播的形式由优化器更新每一层的权重参数。随即进行下一次训练。直到所有数据完成训练,即完成了一轮训练。随后再次从第一组数据开始输入神经网络训练,共进行100轮,完成全部神经网络的训练,将此时的权重与偏置数据保存。
[0094]
步骤十:预测神经网络的搭建,神经网络的结构如图4所示,预测神经网络的结构按顺序分别由跳线块一、跳线块一、跳线块二、跳线块一、跳线块二、跳线块一、全局平均池化层、全连接层组成。其中跳线块一的结构为:
[0095]
(1)卷积块一,由依次顺序连接的卷积层、批归一化层、激活层组成。其中卷积层滤波器大小为3*3,步长为1。激活层采用relu函数激活。
[0096]
(2)卷积块二,由顺序连接的卷积层、批归一化层组成。其中卷积层滤波器大小为3*3,步长为1。
[0097]
(3)卷积块三,由一个滤波器大小为1*1,步长为1的卷积层构成,其输入为卷积块一的输入a。
[0098]
(4)relu激活层,将跳线块一的卷积块二与卷积块三的输出相加并送入relu函数激活。
[0099]
跳线块二的结构为:
[0100]
(1)卷积块四,由依次顺序连接的卷积层、批归一化层、激活层组成。其中卷积层滤波器大小为3*3,步长为2。激活层采用relu函数激活。
[0101]
(2)卷积块二。
[0102]
(3)卷积块五,由一个滤波器大小为1*1,步长为2的卷积层构成,其输入为卷积块四的输入。
[0103]
(4)relu激活层,将跳线块二的卷积块四与卷积块五的输出相加并送入relu函数
激活。
[0104]
全局平均池化层将最后的跳线块一的输出进行压缩提取,转变为列向量,送入全连接层。全连接层七个神经元的输出经过softmax函数激活,最终得到的七个输出即为当前数据对应于七种情况的概率大小。
[0105]
步骤十一:预测数据获取,将16电极的eit采集系统的电极以前额中心为1号电极,逆时针等间隔的将16个电极放置在待检测患者(非训练数据患者组的患者)头部的同一水平面。进行步骤四所述的相同方式的相对模式的安全电流激励和相邻模式的电压检测。进行步骤五所述的相同方式的数据扩充。最终获得待预测数据。
[0106]
步骤十二:数据预测,将步骤九所保存的数据设定为预测神经网络的权重与偏置。将待预测数据经过归一化后送入预测神经网络进行预测,从而获得7种情况对应的概率大小,选取概率最大的情况作为最终的预测结果。
[0107]
图5-7分别为对待预测数据加入信噪比为40db、20db、10db时的不同神经网络的预测结果。本例使用comsol multiphysics 5.4与matlab r2016b联合进行分析建模,运行参数设置参照真实人体组织参数,脑实质层电导率为0.15s/m,颅骨层电导率为0.013s/m,头皮层电导率为0.44s/m。出血电导率设定为0.8s/m,缺血电导率设定为0.8s/m,共有2500组不同位置的出血数据,2500组不同位置的缺血数据,1000组健康数据被输入神经网络进行训练。待预测数据共有500组不同位置出血,500组不同位置缺血,500组健康数据。图中灵敏度代表,待预测数据中疾病数据(出血以及缺血数据,不包括健康数据)被正确识别(位置及类型均正确)的比例;特异性代表,出血或者缺血被正确识别(仅考虑类型正确)的比例;偏差代表健康数据被正确识别的概率;准确率代表所有待检测数据被正确识别(位置及类型均正确)的比例。神经网络的搭建、训练及预测均是由相同电脑使用python软件完成的。从图5-7中可以看到随着噪声的增加,不同神经网络的预测结果均有所下降,然而本发明的预测准确率依然能够保持最高。证明本发明所使用的方法有着较好的抗噪性能,能够更加适应不同的测量环境。
[0108]
以上所述仅为本发明的较佳实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
