包含色甘酸的组合物在制备用于治疗非遗忘性轻度认知障碍的药物中的用途
1.本技术是于2016年11月21日申请的名称为“用于治疗阿尔茨海默病和有关病症的方法”的第201680076618.3号中国专利申请的分案申请。
技术领域
2.本技术涉及包含色甘酸的组合物在制备用于治疗个体中的非遗忘性轻度认知障碍的药物中的用途。
3.相关申请的交叉引用
4.本技术要求2015年11月19日提交的美国系列申请第62/257,616的优先权,其通过引用并入本文。
背景技术:
5.阿尔茨海默病(ad)是一种不可逆的进行性脑部疾病,具有8至20年的平均病程。该疾病导致认知和功能障碍,其可能影响记忆力、思维技能、方向判断、人格,以及以其最严重的形式,影响完成日常生活最基本任务的能力。ad在美国是引起死亡的第六大主要原因。阿尔茨海默病和痴呆症是由与衰老基因突变过程或大脑损伤有关的复杂神经退行性机制引起的疾病中的一部分。
6.估计有540万美国人患有ad。据估计,65岁以上八分之一的人以及85岁以上几乎一半的人患有ad。然而,由于ad诊断不足,超过一半受折磨的人未被确认为阿尔茨海默病患者并且未针对该疾病得到治疗。
7.到2030年,由于“生育高峰期”一代人的老龄化,美国人口中年龄65岁以上的部分预期会翻倍,并且导致阿尔茨海默病患者的数量翻倍。
8.根据国际阿尔茨海默病协会的2015年世界阿尔茨海默病报告,估计全世界有3600万人表现出痴呆。这一数字预期会每20年就翻倍,到2030年达到6600万,而到2050年达到1亿1500万。阿尔茨海默痴呆症占了痴呆症的绝大多数并且据估计是全部痴呆症的50%至75%。
9.全世界痴呆症为严重诊断不足。研究表明,在高收入国家,仅20%至50%的痴呆症病例被正确确认并由主治医生记录。在中低收入国家,该数字远低得多。印度的一项研究表明90%患有痴呆症的病人仍未被确认。随着世界人口老龄化,对于改善那些忍受ad的人的生活而言,早期诊断和治疗将具有重要意义。
10.帕金森氏病(pd,也被称为自发性或原发性帕金森征,运动功能减退僵硬综合征(hrs),或震颤性麻痹)是一种中枢神经系统的退行性病症,其主要影响运动系统。帕金森氏病的运动症状是由黑质(中脑的某区域)中多巴胺生成细胞的死亡所引起的。
11.肌萎缩性脊髓侧索硬化症(als),也被称为卢伽雷氏病和夏科氏兵,是一种牵涉神经元死亡的特定病症。als以肌肉僵硬、肌肉颤搐以及由于肌肉萎缩引起的逐渐恶化的无力为特征。这导致说话、吞咽困难,并最终导致呼吸困难。
associated with dementia:efns guideline)”《神经病学欧洲期刊(eur j neurol.)》((2007)14(1):e1
–
26)。许多具有对ad遗传易感性风险的个体,尽管没有明显的症状,也可以在疾病发展的早期得到确认。在一些情况下,详细的神经心理学试验可以在人满足ad诊断的临床标准前的长达八年,暴露出轻度认知困难。等:“在过渡到阿尔茨海默病期间的多发性认知缺陷(multiple cognitive deficits during the transition to alzheimer's disease)”《内科期刊(j.of internal medicine)》((2004)256(3):195
–
204)。这些早期症状可能影响最复杂的日常生活活动。l.:“日常生活的工具性活动:通向具有轻度认知障碍的个体的阿尔茨海默病诊断的踏脚石?(instrumental activities of daily living:a stepping-stone towards alzheimer's disease diagnosis in subjects with mild cognitive impairment?)”《斯堪的纳维亚神经学报(acta neurol scand.)》((2003)增刊(179):42
–
6)。最明显的缺陷为记忆力损失,其显示为难以记住最近了解到的事实和无法获得新的信息(2004;arn
á
iz等,“轻度认知障碍和临床前阿尔茨海默病的神经心理学特征(neuropsychological features of mild cognitive impairment and preclinical alzheimer's disease)”《斯堪的纳维亚神经学报增刊(acta neurol scand suppl)》(2003)179:34-41)。
19.关于注意力、计划、灵活性以及抽象思考的执行功能的微小问题,或者语义记忆(含义和概念关系的记忆)方面的障碍也可能是ad早期阶段的症状(2004)。淡漠可以在该阶段观察到并且依然是贯穿整个疾病病程的最持久的神经精神障碍。landes等:“阿尔茨海默病中的淡漠(apathy in alzheimer's disease)”《美国老年学会杂志(j am geriatr soc.)》((2001)49(12):1700
–
7)。通常普遍出现抑郁症状、易怒以及减少了对轻微记忆困难的意识。murray e.d.等(2012)。抑郁和精神病的神经病学实践(depression and psychosis in neurological practice)。bradley w.g.等。bradley的神经学临床实践。(第6版)。宾夕法尼亚州费城:爱思唯尔/桑德斯(elsevier/saunders)。
20.在患有ad的人中,逐渐增加的学习和记忆障碍最终导致确诊。在他们的一小部分中,关于语言、执行功能、知觉(失认)或执行移动(失用)的困难比记忆问题更突出。等:“阿尔茨海默病的临床特征(clinical features of alzheimer's disease)”《精神病学和临床神经科学欧洲档案(european archives of psychiatry and clinical neuroscience)》((1999)249(6):288
–
290)。ad不会同等地影响所有的记忆能力。个体生活较老的记忆(情景记忆)、了解的事实(语义记忆)以及内隐记忆(身体对如何做事的记忆,比如使用叉子来进食)相比于新的事实或记忆影响地程度较小。carlesimo等人的“阿尔茨海默病患者的记忆减退:全面综述(memory deficits in alzheimer's patients:a comprehensive review)”((1992)3(2):119
–
69)以及jelicic等人的“患有阿尔茨海默病的患者的内隐记忆表现:简要综述(implicit memory performance of patients with alzheimer's disease:abrief review)”《国际老年精神病学(international psychogeriatrics)》((1995)7(3):385
–
392)。
21.语言问题主要以词汇萎缩和语言流畅度降低为特征,这导致了口头和书写语言的普遍贫乏。(1999)和taler等人“阿尔茨海默病和轻度认知障碍的语言表现:比较综述(language performance in alzheimer's disease and mild cognitive impairment:a comparative review)”《神经心理学临床实验期刊(j clin exp neuropsychol)》((2008)
30(5):501
–
56)。在该阶段,患有阿尔茨海默病的个体通常能够勉强交流基本思想。1999;taler,2008;以及frank e.m“阿尔茨海默病对交流功能的影响(effect of alzheimer's disease on communication function)”《j s c med assoc.》((1994)90(9):417
–
23)。在执行诸如书写、绘画、穿衣的精细运动任务时,可能存在某些运动协调和计划困难(失用症),但是它们通常不会被注意到。1999。随着疾病发展,患有ad的人通常能继续独立执行许多任务,但是对于最需要认知性的活动可能需要辅助或监护(同上)。
22.进行性恶化最终妨碍独立性,此时患者无法执行日常生活的大部分普通活动(同上)。由于无法回想起词汇,讲话困难变得明显,这导致频繁的的错误词语替换(错语症)。阅读和写作技能也同样逐步丧失。同上,frank,1994。随着时间推移和ad发展,复杂的运动序列变得更不协调,因此摔倒的风险增大。1999。在该阶段,记忆力问题恶化,并且该人可能无法辨认出近亲属(同上)。早先是完整的长期记忆开始受损(同上)。
23.行为和神经精神变化变得更加普遍。常见的表现是游荡、易怒以及情感波动,导致哭泣、突然爆发无预谋的侵犯或者抗拒护理(同上)。还可能出现日落综合症。volicer等“阿尔茨海默病中的日落综合征和昼夜节律(sundowning and circadian rhythms in alzheimer's disease)”《美国精神病学杂志(am j psychiatry)》(2001[检索日期2008-08-27]158(5):704
–
11)。将近30%患有ad的人发展为错觉错误识别和其他妄想性症状。1999。受治疗者还注意不到他们的疾病过程和受限(疾病失认症)(同上)。可能发展为尿失禁(同上)。这些症状给亲戚和照顾者带来压力,这可以通过将个体从家庭护理移送至其他长期护理机构来减少(同上)。gold等“何时结束家庭护理:患有痴呆症亲戚的护理者的效果的纵向研究(when home caregiving ends:a longitudinal study of outcomes for caregivers of relatives with dementia)”《美国老年学会杂志(j am geriatr soc.)》((1995)43(1):10
–
6)。
[0024]
在ad的最后阶段期间,个人完全依赖护理者。1999。语言减少到简单短语或者甚至单个词语,最终导致完全丧失说话能力。同上;frank,1994。尽管丧失了口头语言能力,人通常仍能够理解并返回情感信号。1999。尽管仍然存在侵略性,但是极度淡漠和衰竭是更为常见的结果(同上)。患有ad的人将最终在没有辅助的情况下无法执行甚至最简单的任务(同上)。肌肉量和移动性恶化到使其卧床不起的程度,并且他们丧失了自己进食的能力(同上)。ad是一种绝症,致死原因通常是外部因素,比如感染褥疮或肺炎,而不是该疾病本身(同上)。
[0025]
对ad的治疗将需要解决发病机理的多种触发因素。人们认为在ad患者的大脑中有两种主要的神经病理:(a)主要由β-淀粉样蛋白(aβ)肽组成的细胞外蛋白斑块,也被称为淀粉样蛋白斑块;以及(b)由神经元内发现的τ蛋白组成的原纤维的细胞内缠结,也被称为τ缠结。aβ的神经毒性寡聚体的出现和扩散被广泛认为是导致神经元损伤的关键触发因素,这随后会导致细胞内τ缠结的累积,并最终导致ad发病机理中的神经元死亡。
[0026]
aβ肽(长度为37至43个氨基酸)通过天然淀粉样蛋白前体蛋白或app的顺序分裂形成。karran等“阿尔茨海默病的淀粉样蛋白级联反应假说:疗法发展的评估(the amyloid cascade hypothesis for alzheimer’s disease:an appraisal for the development of therapeutics)”《自然综述(nature reviews)》((2011)10:698-712)。长度为40或42个氨基酸的异常aβ肽亚型(aβ-40/42)错误折叠成低聚体的聚合物,其生长到原纤维内而在大
脑中累积为淀粉样蛋白斑块。对于ad发病机理更重要的是,aβ的另一种命运是开始阻塞在神经元突触中,在这种情况下它们妨碍了突触传递,这最终导致神经元退化和死亡。haass等“神经退化中的可溶性蛋白低聚体:来自阿尔茨海默病淀粉样蛋白β-肽的经验(soluble protein oligomers in neurodegeneration:lessons from the alzheimer’s amyloidβ-peptide)”《自然综述分子细胞生物学(nature reviews mol.cell biol)》((2007)8:101-112);hashimoto等“载脂蛋白e,特别是载脂蛋白e4,增加了淀粉样蛋白β肽的低聚反应(apolipoprotein e,especially apolipoprotein e4,increases the oligomerization of amyloid beta peptide)”《神经科学期刊(j.neurosci.)》((2012)32:15181
–
15192)。
[0027]
通过另一种ad触发因素,也就是大脑中的慢性局部炎症反应,加剧aβ寡聚体介导的神经元中毒的级联反应。krstic等“破解迟发性阿尔茨海默病的潜在机制(deciphering the mechanism underlying late-onset alzheimer disease)”《自然综述神经学(nature reviews neurology)》((2012):1-10)。ad具有慢性神经炎症成分,其特征在于存在大量与淀粉样蛋白斑块相关的小神经胶质细胞。heneka等“利用pparγ激动剂吡格列酮和布洛芬的急性治疗降低了appv717i转基因小鼠的神经胶质炎症和a 1
–
42水平(acute treatment with the pparγagonist pioglitazone and ibuprofen reduces glial inflammation and a 1
–
42levels in appv717i transgenic mice)”《大脑(brain)》((2005)128:1442
–
1453)。imbimbo等“nsaids对治疗阿尔茨海默病或轻度认知障碍是否有用(are nsaids useful to treat alzheimer’s disease or mild cognitive impairment)”《前沿衰老神经科学(front.aging neurosci)》((2010)2(文章19):1-14)。这些表达环氧化酶(cox1/cox2)的小胶质细胞吞噬淀粉样蛋白寡聚体后被活化,从而分泌促炎细胞因子。hoozemans等“舒缓发炎大脑:非甾体抗炎药对阿尔茨海默病病理的效果(soothing the inflamed brain:effect of non-steroidal anti-inflammatory drugs on alzheimer’s disease pathology)”《中枢神经系统和神经系统疾病-药物靶标(cns&neurological disorders-drug targets)》((2011)10:57-67);griffin t.s.“什么引起了阿尔茨海默病?(what causes alzheimer’s?)”《科学家(the scientist)》((2011)25:36-40);krstic,2012。该神经性炎症反应,除了促进穿过血脑屏障的局部血管渗漏之外(zlokovic b“阿尔茨海默病和其他病症中到神经退化的神经血管途径(neurovascular pathways to neurodegeneration in alzheimer’s disease and other disorders)”《自然综述神经科学》(2011)12:723-738),已经涉及通过调节γ-分泌酶活性促使异常aβ肽40/42的进一步产生(yan等“抗炎药疗法改变阿尔茨海默病动物模型中β-淀粉样蛋白处理和沉积(anti-inflammatory drug therapy altersβ-amyloid processing and deposition in an animal model of alzheimer’s disease)”《神经科学期刊(j.neurosci.)》((2003)23:7504-7509);karran,2011)并且对成年人大脑中的海马神经发生有害。gasparini等“阿尔茨海默病的非甾体抗炎药(nsaids):旧的和新的作用机制(non-steroidal anti-inflammatory drugs(nsaids)in alzheimer’s disease:old and new mechanisms of action)”《神经化学期刊(j.neurochem)》((2004)91:521-536)。因此,神经炎症与淀粉样蛋白寡聚体介导的神经元中毒造成了一种循环,导致进行性神经功能障碍和神经元细胞死亡扩散到ad个体的整个大脑中。
[0028]
研究人员相信,未来用来减缓或终止ad发展并保留脑部功能的治疗(疾病缓解治
疗)当在疾病的早期阶段给药时是最有效的。未来,当其可用时,生物标记成像对于哪些个体处于这些早期阶段且应当接受疾病缓解治疗是必不可少的。成像技术对于监测治疗效果和修改动作过程而言也将是关键的。
[0029]
如上所述,aβ神经炎斑块的积聚和包含高磷酸化τ蛋白的神经原纤维缠结被认为是ad的神经病理学标志。近年来,大量研究已经表明,脑脊液(csf)中aβ和磷酸化τ的相对水平可以有效地用作预测ad神经病理存在的生物标记。blennow k.“阿尔茨海默病药物研发中的生物标记(biomarkers in alzheimer's disease drug development)”《自然医学(nat med.)》((2010)16:1218-22)。更具体地,研究已经显示,当与健康对照患者进行对比时,在ad患者以及稍后转化成ad的mci患者中,aβ的csf水平显著降低,与此同时磷酸化τ的csf水平显著提高。andreasen等“基于社区的患者样本中ad的csf-τ的敏感性、特异性和稳定性(sensitivity,specificity,and stability of csf-tau in ad in a community-based patient sample)”《神经学(neurology)》((1999)53:1488-94);buchhave等“在阿尔茨海默痴呆症发作之前的5至10年,β-淀粉样蛋白1-42而不是τ的脑脊液水平已经完全改变(cerebrospinal fluid levels ofβ-amyloid 1-42,but not of tau,are fully changed already 5to 10years before the onset of alzheimer dementia)”《基因精神病学档案(arch gen psychiatry.)》((2012)69:98-106);lanari等“对患有轻度认知障碍患者的转化的脑脊液生物标记和预测:在常规临床环境中的4年随访(cerebrospinal fluid biomarkers and prediction of conversion in patients with mild cognitive impairment:4-year follow-up in a routine clinical setting)”《科学世界期刊》((2009)9:961-6);monge-argil
é
s等“含有轻度认知障碍的西班牙患者的脑脊液中的阿尔茨海默病生物标记(biomarkers of alzheimer's disease in the cerebrospinal fluid of spanish patients with mild cognitive impairment)”《神经化学研究(neurochem res.)》((2011)36:986-93);以及sunderland等“患有阿尔茨海默病的患者的脑脊液中β-淀粉样蛋白1-42水平的降低和τ水平的提高(decreased beta-amyloid1-42 and increased tau levels in cerebrospinal fluid of patients with alzheimer disease)”《美国医学会杂志(jama.)》((2003)289:2094-103)。
[0030]
重要的是,在表现出阿尔茨海默痴呆症之前多年可以看到这些生物标记的相对变化。buchhave,2012。事实上,在对137名mci患者的研究中,buchhave等证实,90%的呈现出在基线处的病理生物标记水平的mci患者在9至10年内发展为ad,并且在转化为ad痴呆症之前的至少5至10年aβ的csf水平完全降低(同上)。在对203名患者(131名患有ad和72名对照)的分析中,sunderland等建议,针对csf aβ的444pg/ml阈值和针对csfτ的195pg/ml阈值分别得到用来区分ad患者和对照者的92%和89%的敏感性和特异性。sunderland,2003。类似地,andreasen等人发现,针对csfτ而言302pg/ml的截断值分别得到用来区分ad患者和对照者的93%和86%的敏感性和特异性。andreasen,1999。
技术实现要素:
[0031]
本发明包括治疗阿尔茨海默病的方法,其包括对有此需要的个体施用治疗有效量的色甘酸。一个实施方案包括其中色甘酸为色甘酸钠。该方法可以进一步包括施用布洛芬。另一实施方案包括其中将色甘酸施用到17.1mg。又另一实施方案包括其中以10mg的量施用
布洛芬。一个实施方案包括其中口服、通过吸入器、静脉注射、腹腔注射或者经皮提供色甘酸。另一实施方案包括其中在治疗一周之后治疗有效量的色甘酸将aβ减少约10%至50%。
[0032]
本发明包括以下方法,其中将色甘酸施用到在血浆中达到约14ng/ml至133ng/ml的色甘酸浓度。一个实施方案包括其中将色甘酸施用到在血浆中达到约46ng/ml的色甘酸浓度。另一实施方案包括其中在约6至60分钟时在血浆中达到该色甘酸浓度。又另一实施方案包括其中在约22分钟内在血浆中达到该色甘酸浓度。
[0033]
本发明还包括以下方法,其中色甘酸在csf中达到约0.3至约0.4ng/ml的平均c
max
。一个实施方案包括其中色甘酸在csf中达到约0.24ng/ml的平均c
max
色甘酸浓度。另一个实施例包括其中布洛芬在csf中达到约2.3至5.2g/nl的平均c
max
的方法。又另一个实施例包括其中布洛芬在csf中达到约3.94g/nl的平均c
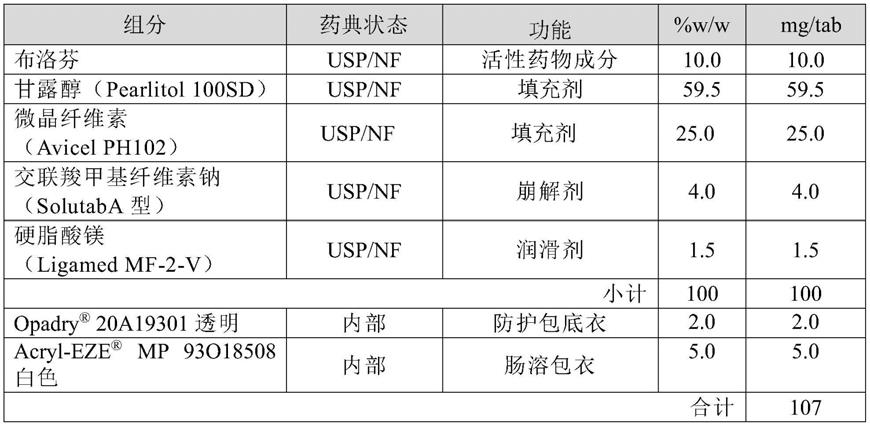
max
的方法。另一实施例包括其中在约2至4小时内达到该布洛芬c
max
的方法。另一实施例包括其中在约2.55小时内达到该布洛芬c
max
的方法。又另一实施例包括其中布洛芬在血浆中达到约25ng/ml至约1970ng/ml的平均c
max
布洛芬浓度的方法。另一实施例包括其中布洛芬在血浆中达到约1091ng/ml的平均c
max
布洛芬浓度的方法。
附图说明
[0034]
图1a-d图1a示出于了色甘酸钠和漆黄素(fesitin)的化学结构。图1b示出了色甘酸钠对aβ
40
和aβ
42
纤维化的影响,在37℃下温育一小时后测得,增加色甘酸钠的浓度(5、50、5000nm)在毫微摩尔级浓度上抑制体外纤维形成。图1c利用tem示出了色甘酸钠对aβ体外聚合的抑制作用,在利用500nm的色甘酸钠温育之后抑制了aβ
42
原纤维的形成。图1d示出了利用色甘酸钠对过表达萤光素酶缀合aβ
42
的两个n-或c-端的hek 293细胞的处理,其以剂量依赖方式显著降低了冷光信号。图1e示出了色甘酸钠对已经含有预先存在的寡聚物但是不影响冷光信号的经调配的培养基的作用。
[0035]
图2a至c。图2a示出了用2.1mg/kg或3.15mg/kg色甘酸钠急性感染ad转基因小鼠7天后,aβ聚集体使tbs可溶性aβ
x-40
和aβ
x-42
的含量显著降低超过50%(对于2.1mg/kg的剂量:aβ
x-40
含量降低39.5%,aβ
x-42
含量降低40.9%;对于3.15mg/kg的剂量:aβ
x-40
含量降低37.1%,aβ
x-42
含量降低46.2%)。图2b示出了使用82e1/82e1elisa分析法测量的aβ寡聚体浓度,请注意:未检测到寡聚体聚集体水平的变化。图2c示出了用6e10和82e1检测抗体对4kda aβ条带进行定量分析,结果表明色甘酸钠降低了单体aβ的含量。
[0036]
图3a至b。图3a示出了在2%triton中连续提取的aβ洗涤剂抗性物质的浓度。图3b示出了在2%sds(图3b)中连续提取的aβ洗涤剂抗性物质的浓度。
[0037]
图4a至d。图4a示出了色甘酸钠对aβ肽的最不溶解组分(甲酸提取物)以及淀粉样蛋白沉积物密度的影响。图4b示出了色甘酸钠仅影响tbs、triton和sds提取物中aβ
x-40
和aβ
x-42
的可溶性池,它总体上并没有改变aβ肽在每个生化组分(tbs、triton、sds和甲酸)中的分布。图4c和4d示出了用抗-aβ抗体免疫组织化学分析法对淀粉样蛋白负荷量和淀粉状蛋白沉积物密度进行定量分析,结果表明在色甘酸钠治疗一周后,淀粉样蛋白肽的细胞外沉积聚集物的量未受影响。
[0038]
图5a至b。图5a示出了施用色甘酸钠使isf aβ
x-40
水平降低30%(pbs:387pm,色甘酸283pm)。图5b示出了在试验中isf aβ
x-42
和aβ寡聚体有相似表现。
steroidal anti-inflammatory drugs)”,《阿尔茨海默病杂志》,(2000)2,37-46;yan,2003;gasparini,2004;imbimbo,2010);
[0044]
b)减少淀粉样蛋白沉积(weggen等人,“nsaids亚组无需活化环氧合酶而降低淀粉样蛋白生成导致的αβ42形成(a subset of nsaids lower amyloidogenicαβ42independently of cyclooxygenase activity)”,《自然杂志》(2001)414:212-216;yan,2003;imbimbo,2010);
[0045]
c)阻断突触中cox介导的前列腺素e2反应。kotilinek等人,“抑制环氧合酶-2提高淀粉样蛋白-β介导的对记忆和突触可塑性的抑制(cyclooxygenase-2inhibition improves amyloid-β-mediated suppression of memory and synaptic plasticity)”,《大脑学》(2008)131:651-664。
[0046]
通过几种机制抑制神经炎症反应将影响ad的发展。布洛芬穿过人血脑屏障(bannwarth b.,“布洛芬对映体在人脑脊液中的立体选择性处置(stereoselective disposition of ibuprofen enantiomers in human cerebrospinal fluid)”,《英国临床药理学杂志(br.j.clin.pharmacol.)》(1995)40:266-269;parepally等人,“非甾体抗炎药的脑吸收:布洛芬、氟比洛芬和吲哚美辛(brain uptake of nonsteroidal anti-inflammatory drugs:ibuprofen,flurbiprofen,and indomethacin)”,《药物学研究(pharm.research)》(2006)23:873-881),抑制促炎细胞因子的产生(gasparini,2004),这应该有助于其用于预防ad发展。然而,当nsaid(例如罗非昔布和萘普生)作为单药治疗用于治疗ad的临床试验时,结果可能不确定,或者结果表明:尽管多项流行病学研究表明服用非甾体抗炎药(包括布洛芬)的个体的ad风险降低(veld,2001;etminan,2003),但是,在作为临床试验中的单药治疗施用时ad发展的风险较高(thal等人,“罗非考昔治疗轻度认知功能障碍的患者的随机双盲研究(a randomized,double-blind,study of rofecoxib in patients with mild cognitive impairment)”,《神经精神药理学》(2005)30:1204-1215;imbimbo,2010)。除了对选择非甾体抗炎药(例如罗非昔布和萘普生)进行ad单药治疗的评估(gasparini,2004年),在轻度中度ad的受试者进行adapt罗非考昔/萘普生治疗试验。aisen等人,“罗非昔布或萘普生与安慰剂对阿尔茨海默病发展影响的研究(effects of rofecoxib or naproxen vs.placebo on alzheimer disease progression)”,《jama》(2003)289:2819-2826;breitner等人,“阿尔茨海默病抗炎药预防试验的广泛结果(extended results of the alzheimer’s disease anti-inflammatory prevention trial)”,《阿尔茨海默氏痴呆症杂志》(2011)402-411。根据流行病学数据,nsaid治疗可能仅在疾病的很早期阶段才有效。imbimbo,2010;breitner,2011。因此,本研究旨在专门针对具有早期ad临床表现的患者。
[0047]
还值得注意的是,在nsaid流行病学研究中,ad的风险降低仅限于可能降低aβ-42肽水平的nsaid,例如布洛芬和吲哚美辛(gasparini,2004;imbimbo,2010)。另外值得注意的是,长期服用低剂量nsaid与高剂量nsaid同样有效。breitner j.,“阿尔茨海默病:变化的认识(alzheimer’s disease:the changing view)”,《神经病学年报(annals neurol.)》(2001)49:418-419;broe等人,“低剂量抗炎药预防阿尔茨海默病(anti-inflammatory drugs protect against alzheimer’s disease at low doses)”,《神经病学杂志(arch neurol.)》(2000)57:1586-1591。
[0048]
炎症反应与淀粉样蛋白产生和寡聚低浓度有关。因此,计算本发明布洛芬剂量为至少治疗该量,同时最小程度地影响全身毒性。
[0049]
布洛芬被批准用于治疗疼痛,并且如上所述用于治疗炎症。对于中度至重度疼痛和炎症,医生开方最大剂量为800mg,一天4次(3200mg)。这个剂量可以施用最多两周。治疗的总治疗剂量为3200mg/天
×
14天,总共44,800mg,相当于217mm。连续使用这个日剂量会产生严重的副作用。非处方剂量是200mg。有人可能每天使用多剂,而有人可能每天使用一剂。
[0050]
每天一剂的年消耗量达到73,000毫克/年。用于治疗估计每日转化为淀粉样蛋白斑块(22-27ng/天)(参考)的abeta的“不可见”神经炎症反应的建议剂量可以为10mg/天,相当于3650mg/年。这个年剂量比两周最大剂量少13倍,或者比治疗疼痛的非处方年剂量少20倍。建议剂量的优点在于无需长期服用药物。
[0051]
alzt-op1b(布洛芬)的剂量理论基础和计算如下:
[0052]
(rs)-2-(4-(2-甲基丙基)苯基)丙酸)mw=206da(206g/mol)
[0053]
口服吸收进入血浆的百分率为98%。结合蛋白质的布洛芬的脑吸收=总量的5%,血浆中游离布洛芬的浓度=总血浆布洛芬的0.5%。因此,血浆中布洛芬的量为剂量的5.5%,其中血浆脑吸收为1-4%。例如,10毫克布洛芬
×
98%=口服片剂吸收后血浆中的布洛芬9.8mg,脑吸收为9.8mg x 5.5%=0.54mg,因此,吸收范围为血浆中剂量的1-4%=5.4ee-4g x 1%脑吸收=5.4ee-6g/206g/mol=2.6ee-8mol/1.5l脑容量=每l脑17.5nm布洛芬。4%的计算如下:21.6ee-3g x 4%脑吸收=21.6ee-6g/206g/mol=1.05ee-7mol/1.5l脑容量=每l脑70nm(或1%的四倍)。因此,服用10mg布洛芬片剂在脑中的浓度估计为17.5-70nm。粗略估计,这个浓度与治疗aβ每日形成引发的潜在炎症反应相关。
[0054]
在ind和i期研究中,对24名人类受试者的血浆和csf水平的评估是在给健康志愿者(年龄55-79岁)口服10mg或20mg布洛芬后进行的。
[0055]
布洛芬在血浆中的初步pk曲线特征在于不规则吸收模式,通常具有滞后时间。人体药代动力学数据表明:口服10mg布洛芬的血浆布洛芬浓度为:在95.4
±
85.9min(范围:12分钟至6小时)时,c
max 1091
±
474.6ng/ml(范围:25.5-1970.0ng/ml)。血浆中表观t
1/2
为1.93
±
0.32h(范围:1.5-2.5小时),表明从血浆中适度清除。
[0056]
口服10毫克剂量后,长达4小时的观察时间间隔中,在2.55
±
0.961h(范围:2.0-4.0小时)时,csf中布洛芬的平均c
max
为3.94
±
1.292ng/ml(范围:2.3-5.2ng/ml)。据估算,脑中布洛芬的水平(19.2
±
6.3nm)足以治疗由aβ每日形成导致的潜在炎症反应。
[0057]
因此,估算10mg布洛芬片导致脑浓度(836ng)或者比治疗所需的剂量22-27ng大4倍。结果表明,脑中布洛芬纳摩尔浓度可以治疗由aβ每日形成导致的潜在炎症反应。在一些实施例中,这个药物剂量以与一种或多种抗淀粉样蛋白药物的混合物的形式作为一种特定治疗或作为标准疾病治疗的辅助治疗。
[0058]
总之,nsaid可能通过几种机制抑制神经炎症反应并影响ad发展。当与抑制aβ寡聚化的药物一起施用时。
[0059]
对于色甘酸剂量的示例,计算如下。色甘酸钠:5,5
′‑
(2-羟基丙烷-1,3-二基)双(氧)双(4-氧代-4h-苯并吡喃-2-羧酸)mw=512da(512g/mol)。色甘酸的剂量理论基础和计算如下。(1)干粉吸入器(dpi)结果表明:每17.1mg api,4-5mg色甘酸(具有全身吸收所需的大小《3μm的颗粒的冲击器部分中)被送入下呼吸道,以供全身吸收。4-5ee-3g/512g/mol=
7.8-9.8微摩尔的色甘酸血浆水平。如果色甘酸从血浆吸收入脑0.2-1%=16-98纳摩尔除以/1.5l脑=脑中11-66nm色甘酸钠/l(每日)。因此,用azhaler装置吸入的17.1mg色甘酸可能导致脑浓度为11-66nm。
[0060]
人体药代动力学数据表明:在吸入17.1mg剂量的色甘酸后,血浆中色甘酸的浓度在22.8
±
16.6min(范围:6-60min)时达到最大值46.7
±
33.0ng/ml(范围:14-133ng/ml)。色甘酸从血浆中清除很快,半衰期为1.75
±
0.9h(范围:0.6-3.7小时)。在吸入17.1mg色甘酸后,csf中平均c
max
色甘酸浓度在3.72
±
0.704h时为0.24
±
0.077ng/ml(范围:0.2-0.4ng/ml),相当于0.47
±
0.15nmol/l。脑中这种色甘酸水平(0.47nmol/l x 1.5l=0.70nmol)足以控制每日估计22-27ng(27ng/512mw=0.06nmol)的淀粉样蛋白斑块和相关的炎症反应。
[0061]
并且,34.2mg吸入剂量范围为0.36
±
0.17ng/ml(范围:0.16-0.61ng/ml),相当于色甘酸浓度0.71nm。假设4小时是最大值,具有与8小时相似的洗出曲线相似,则将推断出csf倍增浓度为1.41nm。这个浓度意味着:比控制每日估计在脑中产生的22-27ngr(27ngr/512mw=0.06nm)斑块的剂量高出一个数量级(23倍)。建议长期日剂量为17.1mg,这个剂量足以减缓或阻止聚合反应,但不影响药物长期使用的潜在毒性。
[0062]
在一些实施例中,提出了特定剂量或计算剂量的色甘酸和其他抗aβ剂用于控制疾病发展,用作单个疾病的治疗,或并发有其他神经退行性靶向疾病(例如阿尔茨海默病)的治疗(单独服用或作为混合物服用)。
[0063]
联合治疗范例用于减轻导致神经变性和神经元死亡的多重触发因素。如果ad发展在早期阶段得到控制,那么由于神经元可塑性和海马中神经形成得到缓解或改善,认知能力障碍可能被逆转(kohman等人,“神经形成、炎症和行为(neurogenesis,inflammation and behavior)”,《大脑、行为和免疫学杂志(brain,behavior,and immunity)》(2013)27:22-32)。已有人提出联合治疗范例可改善认知,并且起到对标准治疗的辅助治疗的功能以使结果最优化。
[0064]
除了改善进行性ad患者长期护理产生的昂贵医疗成本,ad发展的缓解还可能潜在地改善患者的生活质量。
[0065]
试验用药alzt-op1b(布洛芬)是非选择性cox抑制剂,作为nsaid用于治疗炎症。这类药物还包括阿司匹林、塞来昔布、氯芬酸、酮洛芬、酮咯酸、萘普生、吡罗昔康和舒林酸。这些药物通常用于治疗轻度至中度疼痛、发热和炎症,并且还具有抗血小板作用,但均比不上阿司匹林。
[0066]
cox酶将某些脂肪酸转化为前列腺素。根据药物说明服用布洛芬可以通过阻断前列腺素的产生发挥作用,前列腺素是我们身体因为疾病和受伤而释放的一类物质。前列腺素导致疼痛和肿胀(炎症);它们在大脑中释放,还会导致发烧。前列腺素位于以cox酶为起点的反应“链”的末端,导致对疼痛、发热和血管舒张(血流增加或炎症增加)的敏感性增加。因此,通过抑制这个反应链的开始,布洛芬减少疼痛、发热和炎症。因为布洛芬阻断两种cox酶的活性,所以它被认为是非选择性cox抑制剂nsaid。
[0067]
如上所述,通过几种机制抑制神经炎症反应将影响ad的发展。布洛芬穿过人血脑屏障(bannwarth,1995;parepally,2006),抑制促炎细胞因子的产生(gasparini,2004),这应该有助于其用于预防ad发展。然而,当非甾体抗炎药(例如罗非昔布和萘普生)作为单药治疗用于治疗ad的临床试验时,结果可能不确定,或者结果表明:尽管多项流行病学研究表
明服用非甾体抗炎药(包括布洛芬)的个体的ad风险降低(veld,2001;etminan,2003),但是在作为临床试验中的单药治疗施用时ad发展的风险较高(thal,2005;imbimbo,2010)。除了对选择非甾体抗炎药(例如罗非昔布和萘普生)进行ad单药治疗的批评(gasparini,2004年),在轻度至中度ad的受试者进行adapt罗非考昔/萘普生治疗试验(aisen 2003;breitner,2011)。根据流行病学数据,nsaid治疗可能仅在疾病的很早期阶段才有效(imbimbo,2010;breitner,2011)。因此,在本临床试验中,选择具有早期ad临床表现的患者进行研究。
[0068]
值得注意的是,在nsaid流行病学研究中,ad的风险降低仅限于可能降低aβ-42肽水平的nsaid,例如布洛芬和吲哚美辛(gasparini,2004;imbimbo,2010),并且长期服用低剂量nsaid与高剂量nsaid同样有效(broe,2000;breitner 2001)。因此,在这个az治疗alzt-op1试验的一个组中,10mg布洛芬作为口服片剂(alzt-op1b)使用。这个剂量大大低于非处方批准的剂量。结合色甘酸吸入治疗(alzt-op1a),我们将检验如下假设:用布洛芬抑制低水平神经炎症反应将明显有助于预防由于ad发展导致的认知能力下降。
[0069]
布洛芬(alzt-op1b)属于非甾体抗炎药(nsaid)。对于本项研究,在每天同一时间服用(口服)10mg布洛芬片(作为alzt-op1a),用于预防和/或减缓ad中所观察到的神经炎症反应。这种药是fda批准的,多年来用于非处方药(otc),然而,本研究使用比otc更小的剂量。
[0070]
布洛芬片的有效成分是(
±
)-2-(对异丁基苯基)丙酸(usp),其是丙酸衍生物中的一种有机化合物。布洛芬是一种稳定的白色结晶粉末,熔点为74-77℃,微溶于水(《1mg/ml),易溶于有机溶剂(例如乙醇和丙酮)。它的pka为4.4-5.2。
[0071][0072]
用药途径、剂量、方案和治疗时间
[0073]
在治疗期间,布洛芬可以用水口服,每天一次(口服)。
[0074]
片剂可以涂覆有肠溶包衣,用于控制消化系统中药物吸收的位置,以避免可能的不良反应,例如与长期服用nsaid相关的胃肠溃疡和胃出血。肠溶包衣片旨在避开胃中的高酸性环境(约ph3),并溶解于小肠中的碱性环境(约ph7-9)。本实施例中,布洛芬的日剂量比用于治疗疼痛、发烧和炎症的处方日剂量少80-100倍。
[0075]
色甘酸的说明
[0076]
试验用药alzt-op1a(色甘酸)是一种合成色酮衍生物,20世纪70年代就被fda批准用于治疗哮喘。对于哮喘治疗,将色甘酸粉末微粉化以用于通过干粉吸入器(spinhaler装置)吸入肺部。也已经开发了液体鼻制剂和眼用制剂,用于治疗鼻炎和结膜炎。
[0077]
色甘酸的作用机制特征在于:其作为肥大细胞稳定剂,抑制细胞因子从活化的淋巴细胞中释放出来,同时阻止组胺从肥大细胞中释放出来(netzer等人,“色甘酸钠在哮喘治疗中的实际作用的综述(the actual role of sodium cromoglycate in the treatment of asthma
–
a critical review)”,睡眠呼吸杂志(sleep breath)(2012)16:1027-1032;keller等人,“药物传递系统不足是阻碍吸入色甘酸二钠的临床疗效的原因吗?(have inadequate delivery systems hampered the clinical success of inhaled disodium cromoglycate?)”,反思时刻杂志(time for reconsideration)(2011)8:1-17。色甘酸每日四次的用法用于预防过敏性哮喘和运动性哮喘,而非急性发作。
[0078]
我们的研究显示了色甘酸的一种新的作用机制,其与其抑制免疫反应的作用一起,使该批准的药物重新用于潜在地阻止或减缓ad进展。这些研究表明,色甘酸结合aβ肽并抑制其聚合成寡聚物和更高级聚集体。对aβ聚合的抑制将抑制淀粉样蛋白介导的神经元中毒并恢复这些异常aβ寡聚体通到脑外而不是积聚。此外,我们已经表明色甘酸在动物模型中透过血脑屏障,从而在吸入色甘酸后,血浆生物利用度将转化为足以干扰aβ低聚和积聚的脑中的浓度。
[0079]
我们使用app/ps1转基因小鼠(其在脑中产生淀粉样蛋白负荷)对aβ动物模型的研究提供了alzt-op1a治疗获益的统计学显著证据。对转基因动物施用色甘酸而不是模拟治疗,防止了在年龄匹配的健康非转基因动物中观察到的morris水迷宫试验中降低记忆能力。两种其它已知的淀粉样蛋白结合剂的相似施用在这种阿尔茨海默氏转基因动物模型中未能提供任何益处。这些结果表明,alzt-op1a治疗减缓ad转基因动物模型中由脑淀粉样蛋白负荷引起的学习和记忆下降。
[0080]
色甘酸钠是5,5'-[(2-羟基三亚甲基)二氧基]双[4-氧代-4h-1-苯并吡喃-2-羧酸]的二钠盐并是一种水溶性、无臭、白色、水合结晶粉末。
[0081]
表1-alzt-op1a(色甘酸)制剂
[0082][0083]a色甘酸钠(usp)的重量为每粒胶囊的以无水计为17.1mg(按原样计,每粒胶囊18.6mg)。
[0084]b羟丙基甲基纤维素胶囊仅用于通过干粉吸入器计量和递送药物产品并在施用期间不被摄入。
[0085]
色甘酸的剂量取决于受试者的各种情况,例如疾病状况、健康、年龄、性别、体重等。当制剂被配制成用于吸入时,典型地,单剂量色甘酸的量为约5至约20mg,优选地约10至19mg,以及更优选地,量为约15至18mg。在一个具体的实施方案中,色甘酸的量为约17.1mg。
[0086]
例如,制剂可以含有制备成利用干粉吸入器装置使用的色甘酸粉末掺混物。每个单位将包含17.1mg色甘酸和药学上可接受的赋形剂。该制剂可以每日施用两次(34.2mg),其小于当前施用用以治疗哮喘的每日四次批准剂量水平(每天80mg色甘酸总量)的色甘酸剂量的50%。
[0087]
对于每日施用,典型地,色甘酸的量将为约5mg至约45mg;优选地,日剂量的量为约20mg至约38mg,更优选地,该量为约30mg至约36mg。例如,34.2mg色甘酸(17.1mg色甘酸钠,每天两次,早晚使用干粉吸入器吸入)的日剂量将抑制中风后神经炎症并限制肥大细胞迁移/脱粒、胶质激活和神经元损失以及潜在地减缓认知衰退。
[0088]
当与布洛芬一起施用时,典型地,色甘酸以约17.1mg的量施用,布洛芬以20mg施用(例如两次连续口服施用10mg剂量)。替代地,色甘酸以34.2mg施用(例如两次连续施用17.1mg吸入剂量)并施用20mg布洛芬。
[0089]
制造的胶囊被泡封以防止暴露于可能对药物稳定性产生负面影响的湿气、光和其它环境因素。所有产品的包装和标签都应符合cgmp、gcp、当地、联邦和国家特定的规定和要求。
[0090]
虽然本文已经说明和描述了本发明的某些特征,但是本领域的普通技术人员现在将想到许多修改、替换、改变和等同物。因此,应该理解的是,所附权利要求旨在覆盖落入本发明真实精神内的所有这些修改和改变。
[0091]
实施例
[0092]
u.s.p.级的色甘酸钠购自spectrum chemical mfg.corp.(gardena,ca)并溶解于无菌磷酸盐缓冲盐水(pbs)中。将100mm的原液用于体外实验,将10.2mm用于体内施用。在体外,将色甘酸钠原液以10nm、10μm或1mm的最终浓度直接稀释于细胞培养基介质中,而在体内腹膜内注射之前在bulbecco's磷酸盐缓冲盐水(dpbs)中制备1.02mm的化合物溶液(以三种不同剂量:1.05mg/kg、2.1mg/kg或3.15mg/kg体重)。使用分别溶解于dmso和甲醇中的合成a肽(rpeptide,bogart ga)以及硫代黄素-t(sigma-aldrich)进行体外淀粉状蛋白原纤维化测定。对于体外外排和小胶质细胞摄取测定,合成的aβ
40
和aβ
42
肽购自peptide institute,inc。以1mg/ml的浓度在1,1,1,3,3,3-六氟-2-丙醇(hfip,kanto chemical)中再悬浮后,将肽干燥,在含有2%(v/v)me2so(kanto chemical)中重新溶解并用0.2mm过滤器过滤。aβ
40
和aβ
42
的原液以50nm施用在细胞培养物中。
[0093]
实施例1:体外aβ纤维化寡聚化和解离测定
[0094]
使用以250μm的浓度溶于dmso的aβ
40
和aβ
42
并超声处理1分钟进行体内纤维化测定。将aβ
40
和aβ
42
在96孔板(corning,tewksbury,ma)中用人工csf溶液(125mm nacl、2.5mm kcl、1mm mgcl2、1.25mm nah2po4、2mm cacl2、25mm nahco3和25mm葡萄糖,ph7.3)在200μl的测定体积中稀释至5μm。加入10μm硫代黄素-t和浓度逐渐增加的色甘酸钠(5nm,50nm和500nm)后,通过加入0.5mg/ml硫酸肝素(sigma,st.louis mo)开始纤维化过程。将dmso作为对照。使用m3微板读数器分别在450nm和480nm的激发和发射波长下测量荧光强度,由此在室温下每10分钟检测纤维化的进展,持续60分钟。使用由m3平板读数器提供的软件在0时刻
读取的荧光对结果进行背景标准化。
[0095]
使用aβ分裂荧光素酶互补测定在体外进行积聚和寡聚体解离测定。为了评价色甘酸钠对aβ寡聚体形成的影响,将设计为稳定过表达与aβ
42
缀合的高斯荧光素酶(gluc)的n-和c-末端片段的hek 293细胞系在不含或含10nm、10μm或1mm色甘酸钠下在37℃下温育12小时。收集来自这些细胞的条件培养基,加入10nm腔肠素,并使用wallac 1420(perkinelmer)测量荧光素酶活性。通过在37℃下,将pbs或色甘酸钠(10nm、10μm或1mm)与过表达每一半与aβ
42
融合的gluc的原始hek293细胞的条件培养基温育12小时来进行寡聚体解离测定。测定荧光素酶活性。
[0096]
通过透射电子显微镜分析aβ
42
原纤维形成
[0097]
通过进行tem分析证实了色甘酸的抗原纤维生成特性。简而言之,在加入或不加入浓度为5nm或500nm的色甘酸钠下,将合成aβ
42
在37℃下以0.2mg/ml的浓度溶解在pbs中48小时。温育48小时后,在室温下将15μl的aβ
42
原纤维溶液吸附在碳涂覆的em栅格上20分钟。在无菌pbs和ddh2o中洗涤3次后,使栅格干燥,然后用2%(w/v)乙酸双氧铀水负染色两次,持续8分钟。然后将每个栅格在脱气ddh2o中短暂洗涤,空气干燥,并通过tem以150,000x的放大率成像。
[0098]
体外小胶质细胞摄取测定
[0099]
进行aβ摄取的体外评估。简而言之,从胎儿脑组织样品中分离人类小胶质细胞(h mg 030,clonexpress,inc.,gaithersburg,md)并将其悬浮于补充有5%fbs、1%青霉素/链霉素和10ng/ml m-csf的培养基(50:50的dmem:f-12)中。将分离的小胶质细胞接种在玻璃底孔板中,并在37℃下用5%co2温育2天,然后用aβ和色甘酸钠处理。培养基改变后,在具有或不具有10nm、10μm或1mm的色甘酸钠下,将小胶质细胞与50nm aβ
42
在37℃下温育16小时。温育后,收集培养基,使用双位点a elisa测量aβ
40
和aβ
42
的水平,并将小胶质细胞固定在4%多聚甲醛中并计数。
[0100]
动物和色甘酸钠治疗
[0101]
appswe/ps1de9(app/psi)购自jackson library。这些小鼠在朊病毒启动子的控制下表达人突变体k594n/m595l以及缺失外显子9的早老素1基因。该ad小鼠模型呈现出在6个月龄时开始淀粉样蛋白沉积的严重表型。在本研究中,将7.5个月大的app/ps1雄性动物每天腹膜内(i.p.)注射1.05mg/kg、2.1mg/kg或3.15mg/kg体重的色甘酸钠或pbs的递增剂量,持续一周。对于间质液(isf)取样,在isf取样前,每日对9月龄雄性app/ps1小鼠i.p.注射最高剂量的色甘酸钠(3.15mg/kg体重)或pbs,持续7天。在最后一次注射isf收集一天后,通过co2吸入对小鼠进行安乐死。然后通过心脏穿刺收集血浆。经心脏pbs灌注后,将脑解剖,将一个脑半球固定于4%多聚甲醛中用于免疫组织化学,而将对侧半球在液氮中快速冷冻用于生化测定。
[0102]
生化样品制备
[0103]
将脑组织样品通过机械弹跳均化器在10倍体积的tbsi(具有蛋白酶抑制剂的tris-缓冲盐水)中均化25次,并在4℃下以260,000g离心30分钟。收集tbs可溶性上清液,然后将颗粒依次在2%triton-100/tbsi、2%sds/tbsi和70%甲酸中均化。
[0104]
夹心elisa和免疫印迹
[0105]
aβ
40
和aβ
42
的浓度分别使用市售试剂盒bnt77/ba27(对于aβ
40
)或bnt77/bc05(对于
aβ
x-42
)测定。对于胍(gdn-hcl)处理,将样品与0.5m gdn-hcl在37℃下温育30分钟。使用82ei/82wi elisa试剂盒定量寡聚aβ物种,其中捕获和检测抗体是相同的。对于免疫印迹,将tbs可溶部分在10-20%novex tris-甘氨酸凝胶上电泳。转移到硝酸纤维素膜上后,将印迹在5%脱脂奶/tbst(含0.1%吐温20的tris-缓冲盐水)缓冲液中封闭1小时。然后在4℃下用抗aβ抗体6e10和82ei探测膜过夜。在室温下与辣根过氧化物酶缀合的二抗mouse true blot温育1小时后,使用ecl试剂盒显色免疫反应性蛋白质并在hyperfilm ecl上检测。使用image j软件通过密度测定法测定信号强度。
[0106]
免疫化学
[0107]
将连续石蜡切片切成4μm并用兔抗人淀粉样蛋白(n)抗体对淀粉样蛋白斑进行免疫染色,随后用生物素化的山羊抗兔二抗进行免疫染色并使用abc elite和dab试剂盒进行显色。使用配备有ccd照相机型号dp70的olympus bx51落射荧光立式显微镜拍摄图像。在应用光学阈值后,使用bioquant软件进行淀粉样蛋白负荷和斑块密度的定量分析。该软件与配备有ccd照相机的立式leica dmrb显微镜的电动平台配合使用。在背景校正后,免疫染色的淀粉样蛋白斑块在10倍物镜下被阈值化以避免不均匀的照明。对于小胶质细胞中aβ的共定位分析,将4μm石蜡切片用小鼠抗aβ抗体6e10(对于a)和兔抗iba1(对于小胶质细胞)进行免疫染色,接着用alexa 488或cy3缀合的二抗进行免疫染色。使用相同的针孔设置和增益,在zeiss lsm 510meta共焦显微镜上采集图像,来获取pbs与色甘酸钠处理的动物之间的所有图片。使用斐济软件进行图像分析后,测定与淀粉样蛋白沉积物共定位的iba1的百分比。对488和cy3通道应用完全相同的阈值,并且选择对应于每个斑块的roi。将此roi应用在cy3通道上(iba1染色)后,进行roi内颗粒的分析并测量与每个淀粉样蛋白沉积物重叠的iba1染色的百分比。
[0108]
体内微透析
[0109]
对isf aβ取样进行体内微透析。简而言之,在异氟醚麻醉下(1.5%o2),利用两个导向套管将小鼠立体定位植入海马(ap-3.1mm,l+/-2.8mm,dv-1.1mm)。在三天的恢复时间之后,开始i.p.注射色甘酸钠。在用色甘酸钠或pbs作为对照接触一周后进行isf取样。对于isf取样,使用1000kda分子探针。在使用之前,用人造脑脊髓液(acsf:单位mm:122nacl、1.3cacl2、1.2mgcl2、3.0kh2po4、25.0nahco3)洗涤探针。然后使用氟化乙烯丙烯(fep)管将探针的出口和入口分别连接到蠕动泵和微量注射泵。探针通过导向套管插入小鼠海马内。植入后,在isf采样之前,将acsf以10μl/min的流速灌注1小时。以0.5μl/min.或0.1μl/min.的流速分别收集用于测量总aβ或寡聚体aβ的isf样品,并将其储存在-80℃下直至aβ测量。在体内微透析取样期间,小鼠清醒并在设计为允许不受限制移动的微透析笼中自由移动,而不对探针组件施加压力。
[0110]
使用反向微透析进行化合物e处理
[0111]
将对侧海马用于该试验。在基线取样4小时后,将100mm在acsf中稀释的β-分泌酶抑制剂化合物e灌注到海马中以快速地抑制探针周围组织中aβ的产生。再测量isf内的水平5个小时。单一对数图由aβ水平制成并推断isf aβ的半衰期。
[0112]
统计分析
[0113]
使用graph pad 5prism软件进行统计分析。在体外,每个试验独立地进行至少三次,并验证正态性。使用单因素方差分析,随后进行bonferroni事后检验,分析三个或更多
组之间平均值的比较。对每只小鼠的体内数据取平均值,并使用非参数kruskal-wallis检验,然后进行dunn's多重比较检验进行分析。为了定量淀粉样蛋白斑块,使用非参数mann-whitney检验分析数据。p值小于0.05被认为是显著的。
[0114]
结果
[0115]
色甘酸钠抑制aβ体外聚合,但不影响预先存在的寡聚体。用硫黄素t试验测试色甘酸钠对aβ
40
和aβ
42
纤维化的作用。在增加浓度的色甘酸钠(5、50、5000nm)下,在37℃下温育1小时以纳摩尔浓度抑制aβ原纤维体外形成(图1b)。使用tem,在与500nm色甘酸钠(图1c)温育后,抑制aβ
42
原纤维的形成,而在较低浓度(50nm)下没有检测到作用。使用分裂荧光素酶互补方法来特异性监测寡聚体形成,利用色甘酸钠处理过表达荧光素酶缀合的aβ
42
的n-或c-末端的hek 293细胞以剂量依赖性方式显著降低发光信号(图1d)。但是,这种作用只在色甘酸钠浓度高于10μm时检测到。与硫黄素-t测定的这种差异可能是由于我们的分裂荧光素酶互补方法在细胞环境中进行的事实。此外,该寡聚化测定基于aβ
42
肽的存在,aβ
42
肽比aβ
40
肽形成更多淀粉样蛋白且积聚得更快。相比之下,将色甘酸钠添加到已经包含预先存在的寡聚体的条件培养基中未能影响发光信号(图1e)。这些数据表明色甘酸钠有效地阻止aβ聚合成更高级的寡聚体或原纤维,但不能解离预先存在的聚集体。
[0116]
在app/psi小鼠中用色甘酸钠接触1周显著地降低可溶性aβ的体内含量,但不影响淀粉样蛋白沉积或高度纤维性aβ物种。色甘酸钠干扰aβ体外聚集过程,因此可以分类为抗淀粉样蛋白生成化合物。使用2.1mg/kg或3.15mg/kg色甘酸钠急性接触ad转基因小鼠七天使tbs可溶性aβ
x-40
和aβ
x-42
的含量显著降低超过50%(分别地,2.1mg/kg剂量:39.5%(对于aβ
x-40
),40.9%(对于aβ
x-42
);3.15mg/kg剂量:37.1%(对于aβ
x-40
)46.2%(对于aβ
x-42
))(图2a)。
[0117]
将tbs可溶性部分与0.5m胍(gdn-hcl)在37℃下温育30分钟以解离在aβ与其它蛋白质之间形成的寡聚体或其它复合物。温育后aβ的水平通常比天然条件增加,特别是更易于聚集的aβ
x-42
。用色甘酸钠处理以剂量依赖性方式降低了tbs可溶性aβ的总水平(分别地,2.1mg/kg剂量:50.7%(对于aβ
x-40
),63.3%(对于aβ
x-42
);3.15mg/kg剂量:44.6%(对于aβ
x-40
)76.1%(对于aβ
x-42
))(图2a)。
[0118]
色甘酸钠不会显著改变高级淀粉样蛋白物种的含量。为了进一步检查该结果,还使用82e1/82e1 elisa测定来特异性测定aβ寡聚体的浓度,该82e1/82e1 elisa测定使用相同捕获和检测抗体。同样,未检测到寡聚体聚集体水平的变化(图2b)。tbs可溶性提取物也进行sds-page。使用6e10和82e1检测抗体定量4kda aβ条带表明色甘酸钠降低了单体aβ的量(图2c),证实了初始elisa数据。因为可溶性aβ寡聚体相比于aβ的总水平的低比例,所以没有通过蛋白印迹检测到那些特异性聚集体。
[0119]
在2%triton(图3a)和2%sds(图3b)缓冲液中连续萃取的aβ洗涤剂抗性物种的浓度表明,用最高剂量的色甘酸钠(3.15mg/kg)处理显著降低了aβ
x-40
和aβ
x-42
相比于pbs对照的量。对于考虑的所有部分,色甘酸钠似乎对降低aβ
x-40
比aβ
x-42
有很大影响。
[0120]
研究了色甘酸钠对aβ肽的最不溶解部分(甲酸提取物)和淀粉样蛋白沉积物密度的影响。不溶性aβ水平不受急性色甘酸钠施用的影响(图4a)。因为不溶性aβ肽的水平比最易溶部分高得多,并且因为色甘酸钠仅影响aβ
x-40
和aβ
x-42
在tbs、triton和sds萃取物中的可溶性池,所以不会总体上改变aβ肽在每种生化部分中的分布(tbs、triton、sds和甲酸,图
4b)。用抗aβ抗体免疫组织化学评估淀粉样蛋白负荷的额外定量和淀粉样蛋白沉积物的密度证实,在色甘酸钠处理一周后,淀粉样蛋白肽的细胞外沉积聚集物的量保持不受影响(图4c和4d)。数据表明,当在ad转基因小鼠中短时间施用时,色甘酸钠主要不影响大多数纤维状形式的淀粉样蛋白。
[0121]
总之,结果表明急性i.p.施用色甘酸钠快速减少体内tbs、triton和sds可溶性单体aβ的量,其构成了脑中最可交换的淀粉样蛋白池。
[0122]
色甘酸钠降低app/psi小鼠组织液中aβ
40
的浓度。用色甘酸钠急性接触主要降低可溶性单体淀粉样蛋白肽的量。app/psi小鼠用pbs或色甘酸钠以每天最高剂量(3.15mg/kg体重)i.p.注射1周。急性施用色甘酸钠显著降低isf aβ
x-40
水平30%(pbs:387pm,色甘酸283pm)。isf aβ
x-42
和aβ寡聚体表现相似(图5a和5b)。
[0123]
色甘酸钠降低了aβ在isf内的半衰期,这是一个与小胶质细胞摄取而不是aβ通过血脑屏障流出有关的过程。aβ在isf中的半衰期通过使用γ-分泌酶抑制剂化合物e的反向微透析来估计。小鼠以最高剂量(3.15mg/kg体重)处理。在注射色甘酸钠的小鼠中,施用化合物e仅2小时后,isf aβ水平开始下降,明显比pbs处理的小鼠更快(图6a)。当计算时,色甘酸钠处理的小鼠中isf aβ的半衰期比对照短约50%(图6b),表明在用该化合物处理后isf aβ被更快地清除。
