1.本发明涉及微生物领域与生物技术领域,更具体地,涉及一种宽裂解谱噬菌体及其在肉类冷冻保鲜中的应用,适用于食品防腐剂、食品添加剂领域。
背景技术:
2.随着人民生活水平的提高和对营养健康需求的不断提升,对生鲜肉的需求越来越旺盛。为了满足上述实际需求,将生鲜肉进行分割处理后进行分装,搭配适合的蔬菜后包装成一种半加工品,作为一种轻度加工的产品越来越受到广大消费者的欢迎和喜爱。这种生鲜冷藏包装方式虽然迎合了健康饮食的消费者理念,但加工处理过程中产品极易受污染, 而且流通过程中,流通销售过程中的微生物,尤其是腐败菌和致病菌,仍然是缩短产品货架期、威胁食品安全品质事故的主要原因。在生鲜肉制品的用于生鲜肉保鲜的方法主要有4℃保鲜、0℃以下冰点以上的冰温保鲜以及冷冻保鲜。其中,4℃保鲜和冰温保鲜是目前生鲜肉最常用的保鲜方法,前者贮藏时间较短,贮藏损失和品质劣变较严重,一般3-7天,产品品质即开始发生劣变;后者虽然提高了生鲜肉贮藏时间及品质,一般能将贮藏时间延长至28天左右,但其对贮藏温度的精确度要求较高,不易控制,难于实现工业化生产。而且在这个过程中,很多病原菌可以在冷冻储藏温度下、酸性ph及高含盐量(达10%)的环境中生存、繁殖,从而严重威胁人类的健康。免疫力低弱人群(如婴幼儿、孕妇及老年人)易感染上述致病菌后其临床症状表现包括败血症、脑膜炎、晚期流产,严重时甚至可引起死亡。
3.为了解决上述问题,很多生产厂家在新鲜果蔬的冷藏处理过程中添加大量的抗生素,但是但是近年来,由于抗菌药物的广泛使用,滥用抗菌药物现象日趋严重,致使目前常见致病菌对各种抗菌药物的耐药性问题愈发严重,常见的多数致病菌均出现了程度不同的多重耐药性,并且已经出现了无药可用的超级细菌。目前新药的研发速度已经跟不上细菌产生耐药性的速度。细菌对抗生素的耐药性是全世界健康领域急需解决的主要问题之一,因此,寻找具有广泛来源、安全高效、可广泛应用等特点的新型抗生素替代品迫在眉睫。
4.生物防控的方法近些年逐渐引起了人们的关注,其中,噬菌体疗法作为传统药物疗法的替代方法来防控细菌性病害被寄予厚望。噬菌体作为致病菌的天敌,广泛存在于自然界中(水、土壤、空气),已经大量应用于生物防治领域中。噬菌体在生物防治过程中不是将基因组整合到细菌的染色体后导致目标宿主裂解,而是直接吸附到细菌表面裂解目标宿主,从而达到抑菌的目的,这一特性赋予噬菌体作为病害细菌的天然“杀手”的能力,也在生物防控利用中具有应用潜力。另外,噬菌体不破坏食品其他菌群的生态环境,应用过程中可以防止食品中的二次感染。因此,可以作为食品中有效的抗菌剂,目前利用噬菌体来实现奶制品的贮藏保鲜的研究较为深入,但是应用在生鲜肉的保藏中,尤其是直接应用在低温环境下的例子还很少,其宿主、ph、温度适应谱狭窄严重影响了其应用。
技术实现要素:
5.针对上述技术问题,本发明提供了一种宽裂解谱噬菌体及其在肉类冷冻保鲜中的
应用。
6.本发明所述的一种宽裂解谱噬菌体为噬菌体ecom_sd172-4,分离于本技术单位的肉类水鲜冷鲜库中。
7.本发明所述的噬菌体ecom_sd172-4保藏于中国典型培养物保藏中心,保藏编号为:cctcc no:m 20211030,于2021年8月10日保藏在中国典型培养物保藏中心,地址为武汉市武昌区武汉大学,保藏编号为:cctcc no:m 20211030。分类命名:escherichia coli phage
8.本发明的噬菌体对肠出血性大肠杆菌o157:h7、伤寒沙门氏菌、福氏志贺菌、单核细胞增生性李斯特菌、铜绿假单胞菌、副溶血弧菌等常见的几种肉类冷鲜储存中的常见致病菌都具有强裂解作用,尤其是针对肠出血性大肠杆菌o157:h7和单核细胞增生性李斯特菌具有极强的裂解效果。能够在食品冷藏中用于抑制和/或清除肠出血性大肠杆菌o157:h7、伤寒沙门氏菌、福氏志贺菌、单核细胞增生性李斯特菌、铜绿假单胞菌、副溶血弧菌等病原菌有效防控食品中的细菌污染,大大延长冷鲜肉类食品的货架期和保藏期。
9.进一步的,本发明所述的噬菌体ecom_sd172-4属于有尾噬菌体目肌尾噬菌体科,其短尾丝蛋白的氨基酸序列与已知几种相似性较高的噬菌体的短尾丝蛋白氨基酸序列均具有较大的差异,表明ecom_sd172-4为一株新的噬菌体,具有广阔的研究前景。
10.进一步的,本发明提供一种上述噬菌体菌株的应用,其特征在于:将噬菌体菌株扩增培养、纯化和分装后,用于抑制肠出血性大肠杆菌o157:h7、伤寒沙门氏菌、福氏志贺菌、单核细胞增生性李斯特菌、铜绿假单胞菌、副溶血弧菌等病原菌。
11.所述扩增培养、纯化和分装步骤为:1)对肠出血性大肠杆菌o157:h7培养物进行离心,收集沉淀;2)利用lb培养基对步骤1)所述沉淀进行重悬,得到菌悬液,在菌悬液中加入上述方案所述噬菌体ecom_sd172-4,于37℃条件下培养6~8h后,离心,取上清液,上清液经过0.22 μm滤膜过滤,得到噬菌体ecom_sd172-4悬液;3)分别加rnase a和dnaseⅰ至噬菌体悬液,孵育后加入peg 8000、nacl,摇匀至溶解,冰浴;离心去上清;加sm溶液,充分洗溶管壁及沉淀;加入等体积的氯仿抽提噬菌体悬液中的peg和细胞碎片,离心,回收含有噬菌体颗粒的亲水相,获得纯化的噬菌体。
12.优选的,步骤1)中的肠出血性大肠杆菌o157:h7培养物浓度优选为1
×
10
8 cfu/ml~1
×
10
10 cfu/ml,更优选为1
×
10
9 cfu/ml;本发明对所述离心的参数没有特殊限制,采用本领域常规参数即可;优选的,步骤3)中sm溶液保藏液中可以额外添加10%-20%的甘油。
13.进一步的,其中所述的应用是指对冷鲜食品或者其保藏环境进行病原消杀。
14.其中,对冷鲜食品的应用具体为:将纯化的噬菌体作为食品添加剂,在配料时加入≥104pfu/ml的纯化的噬菌体,用于防止生鲜食品的加工、储存、运输等过程中病原菌的生存和繁殖。也可以将其与海藻酸钠等本领域常见的药学上可接受的赋形剂混合后对生鲜食品进行覆膜或者喷涂,消除病原菌的影响,并保证生鲜食品的品质。
15.优选的,所述药学上可接受的赋形剂包括缓冲液、金属离子和表面活性剂中的一种或几种。
16.优选的,所述的生鲜食品包括但不限于:肉类,或蛋类,或奶制品,或粮食,或蔬菜,
或它们之间的组合加工的固体或液体类食品。
17.进一步的,本发明提供利用所述的噬菌体ecom_sd172-4制备得到的抑菌剂。
18.所述抑菌剂能够抑制常见的革兰阳性菌和革兰阴性菌。具体地,可抑制肠出血性大肠杆菌o157:h7、伤寒沙门氏菌、福氏志贺菌、单核细胞增生性李斯特菌、铜绿假单胞菌、副溶血弧菌等常见的几种肉类冷鲜储存中的常见致病菌。
19.实验证明,本发明中的抑菌剂本身无毒,具有明显的抗菌活性,对肠出血性大肠杆菌o157:h7、伤寒沙门氏菌、福氏志贺菌、单核细胞增生性李斯特菌、铜绿假单胞菌、副溶血弧菌等常见的几种肉类冷鲜储存中的常见致病菌等抑制效果较好,裂解谱较宽,热稳定性较好,耐酸碱能力强,可以用于食品添加剂、食品抑菌剂等,具有进一步开发利用的前景。
20.进一步的,所述的抑菌剂中的有效成分主要为前述的噬菌体ecom_sd172-4。优选地,所述抑菌剂还可以包括相配合的其他特定病原菌的抑制剂。
21.可选地,上述抑菌剂的剂型可以为溶液剂、粉剂、凝胶剂、颗粒剂、冻干剂。
22.可选地,所述抑菌剂中还包含药学上可接受的载体。本文所使用的术语“药学上可接受的载体”指不对生物体造成显著刺激且不消除所给予的活性组分的生物活性和特性的载体或稀释剂。为了将所述药物组合物配制成液体制剂,药学上可接受的载体必须适于无菌和生物相容性。实例包括盐水、无菌水、ringer’s溶液、缓冲生理盐水、白蛋白输注液、葡萄糖溶液、麦芽糖糊精溶液、甘油和乙醇。它们可以单独使用或以其任意组合使用。如果需要,可以加入其它常规添加剂,例如,抗氧化剂、缓冲剂和抑菌剂等。当还与稀释剂、分散剂、表面活性剂、粘合剂和/或润滑剂组合时,还可以将本发明的组合物制备成注射剂和口服剂型(例如,水性溶液、悬浮液和乳液、丸剂、胶囊、粒剂)和其他中间剂型,如冻干剂。
23.有益效果本发明的噬菌体的宿主裂解谱较宽,针对肠出血性大肠杆菌o157:h7、伤寒沙门氏菌、福氏志贺菌、单核细胞增生性李斯特菌、铜绿假单胞菌、副溶血弧菌等常见的病原菌都具有较强的裂解作用,效果显著,可以实现一种噬菌体控制多种病原菌。
24.本发明的噬菌体温度适应性强,而且ph耐受力强。可以在0-60℃的环境下长时间保持活性,而且在ph3-12的范围内稳定存在。在40~60℃中放置1h后仍然可以稳定的保持噬菌活性;在0-4℃保存180d以上也可以稳定保持其效价没有显著。由于其可以在低温环境下发挥作用,而可以直接应用在低温食品冷藏领域中,增加了其适用范围。除了对冷鲜食品的储藏提供帮助外,还可以对储藏环境,储藏装置等进行致病病原菌的消毒和抑制,具有更广泛的应用前景。
25.本发明涉及的噬菌体是从自然界中获得,易于进行工业化生产,由上述噬菌体制备的药物或消毒剂不仅可降低成本;而且无需考虑药物残留问题,能够作为一种具有安全、高效生物消毒剂和药物进行广泛应用。
附图说明
26.图1为双层平板检测纯化噬菌体结果;图2为噬菌体电镜观察结果;图3为37℃噬菌体的动态裂解效果;图4为噬菌体的温度耐受性结果;
图5为噬菌体的ph耐受性结果;图6为噬菌体在巴氏杀菌全脂鲜牛奶中的抑菌作用结果;图7为噬菌体在脱脂灭菌纯牛奶中的抑菌作用结果;图8为噬菌体在全脂灭菌纯牛奶中的抑菌作用结果。
27.图9为噬菌体在肉样中的抑菌作用结果。
具体实施方式
28.下面将更详细地描述本发明的优选实施方式。虽然以下描述了本发明的优选实施方式,然而应该理解,可以以各种形式实现本发明而不应被这里阐述的实施方式所限制。
29.实施例1:噬菌体ecom_sd172-4的分离制备及纯化1、噬菌体分离本发明样品采自本技术单位的生鲜肉类冷库污水,经双层滤纸过滤,将稀释后的样品加入蛋白胨溶液,室温振荡2~4h,取上清5000
×g·
min-1
离心30min,用0.22μm滤膜过滤上清。取1ml上清加入50ml lb培养基中,再加入1ml 肠出血性大肠杆菌o157:h7菌株(购自广东省微生物研究所菌种保藏中心,保藏号g1m1.707)过夜培养物(2倍lb过夜培养),再放置于37℃,150rpm振荡培养过夜,次日取上述培养物以10000
×g·
min-1
,4℃,离心30min,取上清;再用0.22μm滤膜过滤上清,形成噬菌体原液。
30.取2ml过夜培养菌液涂布于20ml lb琼脂平板,待吸收后吸取噬菌体原液0.01ml滴于平板表面;待自然晾干后,置于37℃厌氧培养16~18h,观察点样区域变化。
31.取噬菌体原液0.1ml,进行10倍稀释,取102~106稀释液各0.1ml与过夜培养的宿主菌液0.1ml混匀,加入约5ml 0.6%lb琼脂培养基,混匀后迅速倾倒入lb平板上层,摇匀平置5min,待其凝固,置于37℃厌氧培养12h后,观察噬菌斑形成情况。
32.2、噬菌体纯化取2ml新鲜培养的上述肠出血性大肠杆菌o157:h7菌株过夜培养物,离心,1ml lb培养基重悬,加0.1ml噬菌体[以moi(感染复数)分别1:1、1:10和1:100的比例];加入100ml lb培养基,37℃振荡培养6~8h;取上述培养物以13000
×g·
min-1
,4℃,离心30min,取上清;再用0.22μm滤膜过滤上清,形成噬菌体裂解液。分别加rnase a和dnaseⅰ至噬菌体悬液,终浓度1μg/ml,37℃孵育30min;加9.3g peg 8000,5.8g nacl,摇匀至溶解,冰浴1h;4℃离心10000
×g·
min-1
、30min,去上清;加5ml sm溶液(含10%甘油),充分洗溶管壁及沉淀,室温作用30min;加入等体积的氯仿抽提噬菌体悬液中的peg和细胞碎片,振荡30s;4℃,3000
×g·
min-1
离心15min,回收含有噬菌体颗粒的亲水相,获得纯化的噬菌体,双层平板检测纯化噬菌体(如图1所示)。
[0033]
3、噬菌体电镜检测取纯化噬菌体悬液作电镜观察,加20 μl样本滴在铜网上,待其沉淀15min,用滤纸吸去多余的液体,用2%的磷钨酸染色30min,干燥后电镜观察。
[0034]
如图2所示,噬菌体属于有尾噬菌体目肌尾噬菌体科,头部对称,直径约为91.36
±
1.5 nm,尾长约为105
±
3 nm,尾部直径为17.24
±
2 nm,将该噬菌体命名为ecom_sd172-4。
[0035]
实施例2:噬菌体基因组测序利用illumina公司生产的 novaseq测序仪对噬菌体进行高通量测序
将ecom_sd172-4的基因组在ncbi上进行核苷酸序列比对,结果表明,vb_ecom_sq17基因组全长为164980 bp,与escherichia phage vb_ecom-zq3、escherichia phage s143_2、shigella phage phi25-307比对的覆盖率分别为84%、90%、91%,一致性分别为89.43%、92.21%、93.49%。对ecom_sd172-4基因组进行毒力基因和耐药基因的分析,没有发现编码与毒力或耐药性相关的基因,结果表明将该噬菌体应用于防控食源性病原菌时无潜在的安全风险。
[0036]
文献表明,噬菌体短尾丝蛋白决定宿主范围和裂解谱,ecom_sd172-4编码的短尾丝蛋白的氨基酸序列与这几个相似性较高的噬菌体的短尾丝蛋白氨基酸序列均具有较大的差异,表明ecom_sd172-4为一株新的噬菌体。
[0037]
实施例3:噬菌体ecom_sd172-4裂解谱检测实验选择生鲜肉类常见的污染物作为指示菌,进行裂解谱测定,将lb平板分为若干个区域,吸取不同菌株过夜培养物。所检测的菌株分别为:大肠杆菌0157:h7(如上述),大肠杆菌dh5α;鼠伤寒沙门氏菌(atcc14028),肠炎沙门氏菌(atcc13076),伤寒沙门氏菌ty2,鸡白痢沙门氏菌c79-3;福氏志贺菌yt;单核细胞增生性李斯特菌(保藏号:gim1.228);副溶血弧菌(atcc 17802);腐败希瓦菌sd-bgq;维氏气单孢菌qd2-3(上述各菌株都采购自菌种保护单位或者为本实验室分离留存)。取菌液0.1ml滴于lb平板,将菌液均匀地涂开,待其晾干后,取噬菌体原液0.01ml,分别滴加于涂有不同细菌的平板中,正放待自然晾干后,倒置于37℃培养12h后,观察噬菌体裂解情况。
[0038]
结果如表1所示:噬菌体ecom_sd172-4对11株中的9株有不同程度的裂解圈,其中,对大肠杆菌0157:h7、大肠杆菌dh5α、肠炎沙门氏菌(atcc13076)、伤寒沙门氏菌ty2、单核细胞增生性李斯特菌均有透明裂解圈;对鼠伤寒沙门氏菌(atcc14028)、鸡白痢沙门氏菌、福氏志贺菌、副溶血弧菌虽然产生了裂解圈,但不明显;对腐败希瓦菌、维氏气单孢菌无裂解圈。
[0039]
表1噬菌体ecom_sd172-4的裂解谱宿主菌名称编号裂解程度大肠杆菌0157:h7g1m1.707+++大肠杆菌dh5αsd12+++鼠伤寒沙门氏菌atcc14028+肠炎沙门氏菌atcc13076+++伤寒沙门氏菌ty2++鸡白痢沙门氏菌c79-3+福氏志贺菌yt+单核细胞增生性李斯特菌gim1.228+++副溶血弧菌atcc17802+腐败希瓦菌sd-bgq-维氏气单孢菌qd2-3
‑ꢀ
(注:+表示细菌对噬菌体敏感度较弱,++表示细菌对噬菌体的敏感度中等强,+++表示细菌对噬菌体的敏感度强)实施例4噬菌体ecom_sd172-4对大肠杆菌0157:h7的裂解能力验证
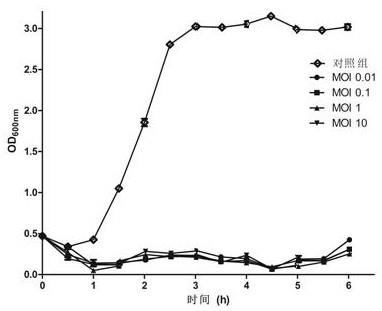
将过夜培养的大肠杆菌0157:h7菌液用lb培养基调整为od
600nm
值约为0.23(约为10
7 cfu/ml),实验组分别按照moi=0.01、0.1、1和10加入不同稀释度的噬菌体ecom_sd172-4(原液约为10
8 pfu/ml,其制备方法为:取大肠杆菌dh5α菌落接种于含有5mllb液体培养基的细菌瓶中,37℃培养8h,取100μl上述菌液于10ml 新鲜lb液体培养基中,再加入100μl于4℃保存的噬菌体ecom_sd172-4,混匀后37℃振荡培养箱中培养12-18h使噬菌体增殖;将增殖液于离心管中,11000
×
g离心 10min去除细菌碎片,上清液用0.22μm滤膜过滤得噬菌体原液,效价约为10
8 pfu/ml)于菌液中混匀,置于37℃培养箱培养,同时设立对照组,仅加入细菌菌液不加噬菌体,每隔30min检测od
600nm
值,共测6个小时,比较加入噬菌体后的od
600nm
值变化。同时分别在3h和6h时取菌液样,采用平板计数法测细菌的数量,并计算细菌浓度。
[0040]
结果如图3所示,表明37℃噬菌体作用6h之内,与对照组相比较,加入不同浓度的噬菌体组中od
600nm
值均稳定处于较低水平,由此可见,噬菌体对宿主菌具有显著的裂解作用,不同作用浓度均能够有效抑制宿主菌的生长。而且结果显示,与起始时菌液浓度相比,在3h时,实验组活菌数分别下降了5.06个log cfu/ml,4.2个log cfu/ml,3.5个log cfu/ml和4.01个log cfu/ml;在6h时活菌数分别下降了3.51个log cfu/ml,2.39个log cfu/ml,2.97个log cfu/ml和2.89个log cfu/ml。
[0041]
实施例5:噬菌体ecom_sd172-4对温度耐受性的测定将噬菌体原液稀释至约10
9 pfu/ml,并分装于2个无菌离心管中,每管各1ml,将离心管分别放置于20℃、30℃、40℃、50℃、60℃、70℃、80℃的恒温水浴锅中,分别在30min和60min后测效价。
[0042]
噬菌体ecom_sd172-4的温度耐受性测定结果如图4所示。结果表明,噬菌体ecom_sd172-4具有很好的温度耐受性,在20℃至60℃时保持活性。
[0043]
实施例6:噬菌体ecom_sd172-4对ph耐受性的测定以lb液体培养基为介质,用naoh和hcl调节ph值(ph 2~13)。取已知效价的噬菌体原液10 μl(10
9 pfu/ml),加入到990 μl不同ph值的蛋白胨水中,37℃水浴2h后测定各离心管中噬菌体的效价。
[0044]
噬菌体ecom_sd172-4的ph耐受性测定结果如图5所示,噬菌体ecom_sd172-4具有较好的酸碱耐受性,在ph为3至12时保持活性。
[0045]
实施例7:噬菌体ecom_sd172-4对奶制品保藏模拟试验1)巴氏杀菌全脂鲜牛奶抑菌试验将o157:h7菌株培养至对数生长期,pbs洗涤离心去除菌液培养基,保留菌体沉淀,取5 ml巴氏杀菌全脂鲜牛奶将细菌稀释至终浓度为1
×
10
5 cfu/ml,设立实验组和对照组。实验组加入1 ml终浓度约为10
8 pfu/ml的噬菌体ecom_sd172-4,对照组不加噬菌体,只加入等体积的sm缓冲液,置于4℃静置培养,并分别于0、4、8、12、24h时间点收集样品,样品采用平板计数法测细菌的数量,并计算全脂牛奶中细菌浓度,绘制抑菌曲线图。
[0046]
如图6所示,噬菌体vb_ecom_sq17在牛奶中的应用试验结果:在4℃下,与对照组相比,在12h时,活菌数下降了0.68个log cfu/ml,在24h时,活菌数下降了1.24个log cfu/ml。
[0047]
2)脱脂灭菌纯牛奶抑菌试验将o157:h7菌株培养至对数生长期,pbs洗涤离心去除菌液培养基,保留菌体沉淀,取5 ml脱脂灭菌纯牛奶将细菌稀释至终浓度为1
×
10
5 cfu/ml,设立实验组和对照组。实验
组加入1 ml终浓度约为10
8 pfu/ml的噬菌体ecom_sd172-4,对照组不加噬菌体,只加入等体积的sm缓冲液,置于4℃静置培养,并分别于0、4、8、12、24、48、72h时间点收集样品,样品采用平板计数法测细菌的数量,并计算脱脂牛奶中细菌浓度,绘制抑菌曲线图。
[0048]
如图7所示,噬菌体ecom_sd172-4在脱脂灭菌纯牛奶中的应用试验结果:在4℃下,与起始细菌浓度相比,在12、24h时,活菌数下降明显,在48、72h时,均已检测不到细菌,而对照组细菌浓度相对稳定,未见明显变化。
[0049]
3)全脂灭菌纯牛奶抑菌试验将o157:h7菌株培养至对数生长期,pbs洗涤离心去除菌液培养基,保留菌体沉淀,取5 ml全脂灭菌纯牛奶将细菌稀释至终浓度为1
×
10
5 cfu/ml,设立实验组和对照组。实验组加入1 ml终浓度约为10
8 pfu/ml的噬菌体ecom_sd172-4,对照组不加噬菌体,只加入等体积的sm缓冲液,置于4℃静置培养,并分别于0、4、8、12、24、48、72h时间点收集样品,样品采用平板计数法测细菌的数量,并计算全脂牛奶中细菌浓度,绘制抑菌曲线图。
[0050]
如图8所示,噬菌体ecom_sd172-4在全脂灭菌纯牛奶中的应用试验结果:在4℃下,与起始细菌浓度相比,在12、24h时,活菌数分别下降了3.2和3.4个log cfu/ml,在48、72h时,活菌数均下降了4.01个log cfu/ml,而对照组细菌浓度相对稳定,未见明显变化。
[0051]
实施例8噬菌体ecom_sd172-4对冻肉保藏模拟试验从超市购买普通冷鲜鸡胸肉、牛肉、羊肉、猪肉、鲫鱼各1份,将每份肉平均分为4份用于平行试验(一份阴性对照,四份重复试验),解冻后放于4℃冰箱备用。24h内用于实验。
[0052]
在实验前对样品进行预处理,在超净台内用灭菌刀在无菌砧板上将肉样尽可能的切成长条状,并确保试验表面平整,每种肉样的试验面积约为5*5cm2。用75%的酒精擦拭一遍,用灭菌的培养皿装好肉样,置于超净台紫外灯下照灭菌处理20min,得到无菌肉样。
[0053]
将处理后的样品置于无菌培养皿中央,平放,平整的试验切面朝上,用移液枪取105cfu/ml的o157:h7菌株10μl随机滴加于各肉样表面,得到样品上人工污染的宿主菌,为了使宿主菌充分吸附到样品表面,将污染肉样置于超净台中风干。
[0054]
实验组加入10ul终浓度约为10
8 pfu/ml的噬菌体ecom_sd172-4,滴加于样品上,尽量覆盖住滴加宿主菌的位置。对照组不加噬菌体,只加入等体积的sm缓冲液,置于4℃静置培养,并分别于0、4、8、12、24h时间点收集样品,加入1ml的pbs(ph=7.2-7.4)缓冲液,将样品用无菌研磨棒研磨破碎,然后13000r/min离心10min。得到含有噬菌体的上清液和含有宿主菌的沉淀,分别稀释到合适的浓度进行双层平板计数和琼脂板涂布计数,并计算样品中细菌浓度,绘制抑菌曲线图。
[0055]
如图9所示,噬菌体ecom_sd172-4在上述各种肉类的保藏中都起到了积极的抑菌效果,在4℃下,与起始细菌浓度相比,在6h时,在鸡胸肉、牛肉、羊肉、猪肉、鱼肉中的活菌数分别下降了1.2、1.1、1.1、0.9、1.1个log cfu/ml,在18h时,上述活菌数分别下降了2. 1、2.3、2.2、2.9、2.1个log cfu/ml,在24h时,上述活菌数分别下降了3. 2、3.5、3.0、3.1、3.2个log cfu/ml,而对照组细菌浓度相对稳定,未见明显变化。
[0056]
实验结果表明:处理组样品的微生物指标均优于对照组,且对样品的色差、感官无明显影响,经上述噬菌体的处理,样品都具有较好的抑菌效果,较好地延缓了脂肪氧化,可以大幅延长商品的货架期,因此上述噬菌体用于奶制品或者肉制品的保鲜加工上具有广阔的发展前景。
[0057]
以上已经描述了本发明的各实施例,上述说明是示例性的,并非穷尽性的,并且也不限于所披露的各实施例。在不偏离所说明的各实施例的范围和精神的情况下,对于本技术领域的普通技术人员来说许多修改和变更都是显而易见的。
