噬菌体解聚酶orf38蛋白在多杀性巴氏杆菌荚膜分型鉴定中的应用
技术领域
1.本发明属于生物领域,涉及噬菌体解聚酶orf38蛋白在多杀性巴氏杆菌荚膜分型鉴定中的应用,本发明还涉及一种多杀性巴氏杆菌荚膜分型鉴定方法。
背景技术:
2.多杀性巴氏杆菌(pasteurella multocida,pm)是可引起多种畜禽巴氏杆菌病的病原体,对养殖畜牧业危害较为严重。该病原的宿主范围较广,可在多种动物之间进行传播,引起动物出血败血症或传染性肺炎。重要的是,pm也能够感染人类,对于免疫体系不健全的个体经过带有病原pm的动物抓伤、咬伤,可因败血症而导致死亡。此外,猪群中猪萎缩性鼻炎(wine infectious atrophic rhinitis,ars)通常与d型多杀性巴氏杆菌(pmd)有关此类疾病广泛存在和流行于全世界范围内的猪场,给养猪业带来了重大的经济损失。除此之外,pm还在猪呼吸道疾病综合征(porcine respiratory disease complex,prdc)中扮演着重要角色。
3.pm传统的分型方法主要是根据血清型进行分型,包括卡特荚膜分型法和赫德尔斯顿菌体或者脂多糖分析法。卡特荚膜分型法主要是运用间接的血凝法将pm分型a、b、d、e和f五个荚膜血清型。而赫德尔斯顿菌体或者脂多糖分析法主要是根据琼脂凝胶扩散沉淀素试验将pm分为1-16个菌体或者脂多糖血清型。目前,对于临床分离得到的pm的血清型鉴定主要根据卡特荚膜分型法。使用常规的pcr方法即可鉴定相应的血清型。
4.传统的pm检测方法通过细菌的纯培养或者通过pcr特异性引物对pmd荚膜血清进行鉴定。pcr检测的方法虽然灵敏度高、特异性强,但需要耗费试剂以及可能出现的核酸污染等问题容易造成假阳性的出现。另外,在规模化养殖场中,pcr检测方法需要专业的技术人员操作,难以满足生产的需要。因此,需要一种简单、快捷、准确的方法来鉴定pm。
5.大量的研究表明,一些噬菌体能够产生降解细菌胞外聚合物基质的多糖解聚酶,继而裂解并杀死宿主菌,噬菌体解聚酶具有化学性质和生物学效应稳定的特点,适合于大量生产,这为多重耐药菌感染的治疗提供了新的思路。由于不同解聚酶对其作用底物有不同的作用结构,并有其特异性的作用方式,因此噬菌体解聚酶在细菌鉴定和分型方面的应用潜力更大,已有研究者利用噬菌体解聚酶开展了肺炎克雷伯菌的荚膜分型。迄今为止,尚未发现有人利用解聚酶对多杀性巴氏杆菌进行荚膜分型。
技术实现要素:
6.本发明的目的是提供噬菌体解聚酶orf38蛋白在多杀性巴氏杆菌荚膜血清分型鉴定中的应用,本发明还提供一种多杀性巴氏杆菌荚膜血清分型鉴定方法以及试剂盒。
7.为实现上述目的,申请人以噬菌体phb01为模板,设计引物并扩增目的片段基因,构建表达载体并转化感受态细胞,最后得到表达噬菌体解聚酶orf38基因的重组蛋白,该蛋白的氨基酸序列如seq id no.2所示,编码该蛋白的核苷酸序列如seq id no.1所示。
8.接着,申请人通过研究蛋白的性能,发现其具有良好的热稳定性和ph稳定性,并能特异性裂解pmd,因此能应用于多杀性巴氏杆菌的荚膜分型鉴定,尤其是荚膜血清型为d的pm鉴定。
9.一种多杀性巴氏杆菌荚膜分型鉴定方法,包括以下步骤:
10.(1)将培养至生长对数期的多杀性巴氏杆菌菌液与含有琼脂的tsb培养基混合,倾倒至下层平板,制备双层平板;
11.(2)使用pbs缓冲液稀释所述噬菌体解聚酶orf38蛋白,将蛋白稀释液点斑至步骤(1)中的双层平板上,孵育后观察结果。
12.优选地,步骤(1)中,所述菌液与培养基的体积比为1:20。
13.优选地,所述pbs缓冲液的ph=6.0。
14.优选地,所述孵育的温度是34-38℃,时间10-15h。
15.一种用于多杀性巴氏杆菌荚膜分型鉴定的试剂盒,该试剂盒含有所述的噬菌体解聚酶orf38蛋白。
16.本发明的有益效果是:
17.(1)首次发现噬菌体解聚酶orf38蛋白仅对pmd有裂解作用,对其它荚膜血清型的多杀性巴氏杆菌(包括a,b,e和f)和其它细菌如大肠杆菌、沙门菌、副猪嗜血杆菌、支气管波氏败血杆菌、链球菌和金黄色葡萄球菌等均没有裂解作用,因此可应用于多杀性巴氏杆菌荚膜分型鉴定。
18.(2)本发明提供了一种有效简便pmd荚膜分型鉴定方法,将所使用的蛋白直接点斑在长满细菌的平板上,在培养箱中即可鉴定出pmd,具有简单、快捷、准确等优点。据我们所知,目前还没有使用该方法来鉴定pmd的报道。
附图说明
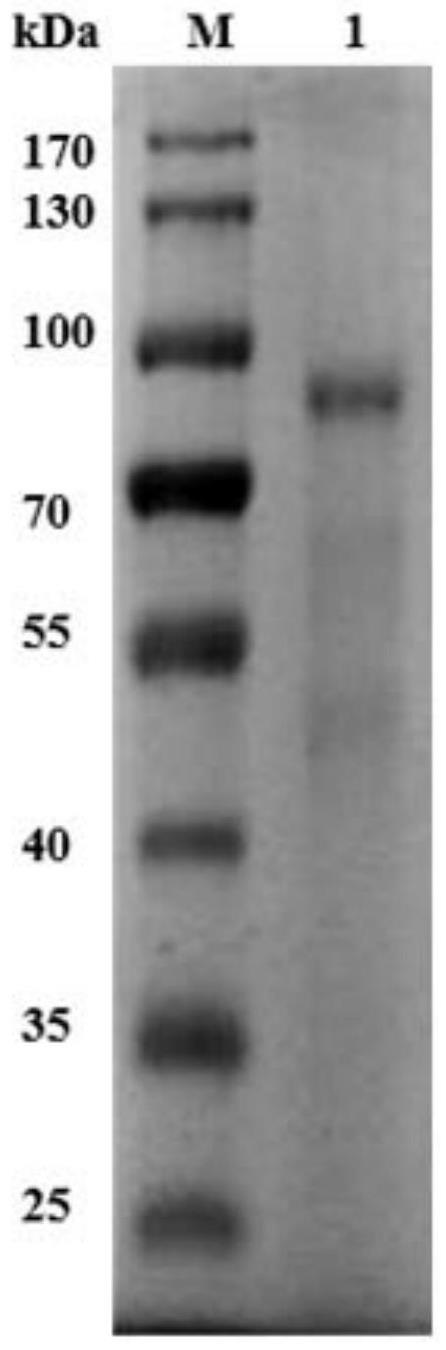
19.图1为orf38重组蛋白纯化后的蛋白胶图结果。
20.图2为纯化后的orf38重组蛋白点斑结果。
21.图3为orf38重组蛋白的ph稳定性。
22.图4为orf38重组蛋白的热稳定性。
具体实施方式
23.下面结合具体实施例对本发明进行详细说明。
24.主要试验材料:
25.噬菌体phb01:保存于山东省农业科学院畜牧兽医研究所。
26.pet-28a载体:购买于invitrogen公司。
27.bl21(de3)感受态细胞:购买于invitrogen公司。
28.实施例1重组蛋白的构建
29.1.基因的扩增
30.以噬菌体phb01为模板扩增目的片段基因orf38(gene id:54980989)。
31.正向引物:5
’‑
ccggaattc atgtcatcaagagatatcagta-3’ecori
32.反向引物:5
’‑
gcgtcgac tcacaattgacaccatttattca-3’sali
33.扩增体系和扩增条件如下:
[0034][0035]
pcr反应程序:98℃预变性5min;98℃预变性20s,60℃退火20s,72℃延伸2min,30个循环;最后72℃延伸10min,4℃保存。
[0036]
2.构建重组质粒
[0037]
(1)200ng的回收目的片段与100ng回收后的pet-28a载体分别与限制性内切酶ecori和sali在37℃酶切2h;
[0038]
(2)将酶切后的产物在t4连接酶的作用下4℃过夜连接;
[0039]
(3)取-70℃冻存的感受态细胞于冰上融化后,取100μl于无菌的1.5ml ep管中,加入连接产物(约10μl),混匀,于冰上放置30min;
[0040]
(4)42℃水浴热击90s,再放回冰上2min;
[0041]
(5)加入400μl tsb液体培养基,37℃200rpm摇床培养45min;
[0042]
(6)取100μl菌液涂卡那kan(50mg/ml)抗性平板,37℃培养至单菌落出现。
[0043]
将连接成功的目的片段pet-28a-orf38送至测序公司测序,随后将鉴定碱基序列无误的重组质粒pet-28a-orf38按照常规方法导入bl21(de3)感受态细胞中。
[0044]
3.蛋白的表达
[0045]
(1)将表达重组质粒的菌株过夜培养,然后按照1:100的比例加入kan抗性培养基lb中,加入诱导剂iptg(40mm)在25℃摇床中振荡培养16h;
[0046]
(2)使用超声破碎仪破碎菌液,破碎10s间隔10s;
[0047]
(3)将蛋白液至-80℃保存以备用。
[0048]
4.蛋白的纯化与鉴定
[0049]
(1)夹好灌制聚丙烯酰胺凝胶的玻璃板,将制好的12%的sds丙烯酰胺分离胶约5ml迅速灌入两玻板的间隙中,留出灌注积层胶所需空间,在分离胶上加入一层异丁醇。
[0050]
(2)分离胶聚合后,倾出覆盖层的异丁醇液体,用去离子水洗凝胶顶部数次,用滤纸片吸净残留液体,再将刚制好的5%积层胶灌入分离胶上,立即插入梳子。
[0051]
(3)待胶全部聚合后拔出梳子,用水洗去加样槽的残留液体,用针头拨掉加样槽内的胶,将齿弄直,固定于电泳装置。
[0052]
(4)加电泳缓冲液,每孔上20μl样品,将电泳装置与电源相接,将电压调到80v,待
溴酚蓝跑到分离胶时,将电压调到120v,等溴酚蓝跑到分离胶底部时关掉电源,取出聚丙烯酰胺凝胶。
[0053]
(5)将聚丙烯酰胺凝胶置于考马斯亮蓝染色液中染色4h以上,取出放入脱色液中脱色数次,每次30~60min,至背景色弱、目的蛋白带清晰为止。
[0054]
(6)通过配置胶确定蛋白的表达量及大小。
[0055]
(7)使用his标签镍柱将蛋白纯化。
[0056]
(8)使用pbs(ph7.2)透析咪唑,使用10-kd蛋白浓缩柱浓缩目的蛋白orf38;
[0057]
(9)使用bsa试剂盒测定最终蛋白的浓度。
[0058]
orf38蛋白纯化后的胶图见图1,其蛋白大小为92.5kd。蛋白纯度检测结果为30μg/ml。
[0059]
实施例2蛋白的活性与稳定性
[0060]
1.点斑测定蛋白的活性
[0061]
取300μlpmd菌液与6ml含0.75%琼脂的tsb培养基混合后,倾倒下层平板,待平板自然晾干后,将纯化后的解聚酶orf38蛋白通过二倍倍比稀释,每个稀释液中取5μl(0.15μg)orf38蛋白点斑至事先准备好的双层平板上,37℃孵育12h观察结果。
[0062]
结果如图2所示,蛋白稀释到8次方仍旧能看到裂解活性。
[0063]
2.蛋白的ph稳定性
[0064]
pmd菌外多糖(eps)由热苯酚法提取。将冻干的eps加入适量的不同ph的pbs缓冲液溶解,达到所需的使用浓度。取900μl eps稀释液(eps为5mg/ml)与100μl orf38蛋白(30μg/ml)混合,在37℃温箱孵育1h。orf38对eps的降解作用可通过3,5-二硝基水杨酸(dns)来进行检测。使用多功能酶标仪在od450
nm
读长下检测数值,其中最高数值的ph被标为100%,其它各组的数值=检测的数值/最佳检测的数值
×
100%。
[0065]
结果如图3所示,重组蛋白在ph4-9保持较高的活性。而在ph为3时,蛋白活性下降超过80%。
[0066]
3.蛋白的温度稳定性
[0067]
orf38对不同温度的敏感性试验与上述ph试验方法一致。不同的是选择最佳pbs缓冲溶液(ph=6.0)来实施温度稳定性实验ph=6.0。混合物分别在20℃、37℃、40℃、50℃、60℃、70℃和80℃环境下孵育1h。使用多功能酶标仪在od450
nm
读长下检测数值,其中在最佳ph(37℃)下的读值被标为100%,其它各组的数值=检测的数值/最佳检测的数值
×
100%。
[0068]
结果如图4所示,蛋白在20-50℃之间活性相对稳定。在60℃时,蛋白活性下降超过20%,而在70-80℃时,蛋白几乎没有活性。
[0069]
实施例3多杀性巴氏杆菌的荚膜分型
[0070]
将本实验室保存的的55株pmd,10株荚膜血清学为a的pm、5株荚膜血清学为b的pm,1株荚膜血清学为e的pm,1株荚膜血清学为f的pm,10株支气管波氏杆菌,10株沙门菌,10株大肠杆菌,10株金黄色葡萄球菌,10株副猪嗜血杆菌和10株链球菌培养至对数期,取300μl上述菌液与6ml含0.75%琼脂的tsb培养基混合后,倾倒下层平板。等平板晾干后,使用pbs(ph=6.0)缓冲溶液稀释orf38蛋白,将5μl(0.15μg)orf38蛋白点斑到双层平板上,倒置在34℃-38℃培养箱孵育12h。
[0071]
表1为orf38蛋白裂解谱试验。使用5μl(0.15μg)orf38蛋白点斑所测试菌株,结果
表明orf38仅对55株不同来源的pmd有裂解作用,对其它菌株没有裂解作用。
[0072]
表1蛋白裂解谱试验
[0073]
菌株名称细菌数目敏感性检测pma10均不敏感pmb5均不敏感pmd55均敏感pme1均不敏感pmf1均不敏感沙门菌10均不敏感大肠杆菌10均不敏感支气管波氏杆菌10均不敏感副猪嗜血杆菌10均不敏感金黄色葡萄球菌10均不敏感链球菌10均不敏感
