一种adc药物旁杀伤活性的检测方法
技术领域
1.本发明涉及抗体偶联药物的药效和特性的检测方法,具体涉及一种adc药物旁杀伤活性的检测方法。
背景技术:
2.抗体药物偶联物(antibody-drug conjugate,adc) 是将单克隆抗体与小分子细胞毒素用连接子连接,因此,adc结合了单克隆抗体的高特异性和小分子毒素的细胞杀伤活性,从而可以提高肿瘤药物的靶向性并减少毒副作用。adc药物杀伤肿瘤细胞的一般药理机制为adc药物中的抗体部分特异性识别并结合肿瘤细胞表面的抗原,adc药物被抗原阳性的肿瘤细胞内吞进入细胞内,并在细胞内降解释放出小分子毒素,小分子毒素杀伤该抗原阳性肿瘤细胞。抗原阳性肿瘤细胞被杀伤后,小分子毒素被释放到该肿瘤细胞周围,膜通透性强的小分子毒素可以透过周围其他细胞的细胞膜,进一步杀伤周围其他细胞。adc药物在抗原阳性肿瘤细胞内降解释放出小分子药物,或在细胞外空间释放小分子药物,杀伤抗原阳性肿瘤细胞周围其他细胞的作用称为旁杀伤或旁观者杀伤作用(bystander killing effect)。
3.越来越多证据显示 :由于肿瘤内部存在高度的异质性,adc药物的旁杀伤效应对于实体瘤上的药效可能是关键性因素之一,评价adc药物的旁杀伤作用也是当前评估adc药物的重要指标之一。在检测旁杀伤效果时,主要是通过目标抗原阳性细胞与目标抗原阴性细胞共同孵育,观测adc药物对抗原阴性细胞的杀伤作用。
4.目前较为经典的体外检测方法是第一三共株式会社用于检测enhertu
®
(ds8201a)旁杀伤作用的方法。her2阳性的kpl-4 和 her2阴性的mda-mb-468 细胞接种于6孔板中共培养,贴壁过夜后加入adc药物,并继续培养5天。培养结束后,消化收集细胞,细胞计数和计算每孔中细胞总数量。细胞用fitc标记的抗her2抗体染色,洗涤,再用流式细胞仪分析fitc阳性和阴性的细胞比例,再根据细胞总数计算各组中fitc阳性和阴性细胞的绝对值。fitc阳性细胞为her2阳性细胞kpl-4,fitc阴性细胞为her2阴性细胞mda-mb-468。旁杀伤效应的强弱主要以mda-mb-468细胞减少的比例确定。
5.该方法采用流式检测法,步骤繁琐,很难同时处理大量样本,无法实现高通量检测。并且细胞消化、计数、染色和流式检测均可能造成较大的误差,导致实验结果不准确,批间重复性差。
技术实现要素:
6.本发明所要解决的技术问题是提供一种易操作、可重复性高且高通量的adc药物旁杀伤活性的检测方法。
7.为达到上述目的,本发明采用的技术方案是:本发明提供一种adc药物旁杀伤活性的检测方法,其包括如下步骤:(1)设置实验组和对照组:其中,所述实验组为将adc药物、目的抗原阳性细胞、荧
光蛋白标记的目的抗原阴性细胞共培养,所述对照组为将目的抗原阳性细胞和荧光蛋白标记的目的抗原阴性细胞共培养;其中,目的抗原为能够与所述adc药物中的抗体特异性结合的抗原;(2)采用荧光细胞计数方法分别检测实验组和对照组共培养后的体系中的荧光蛋白标记的目的抗原阴性细胞的数量,其中,检测到的实验组的荧光蛋白标记的目的抗原阴性细胞的数量为n1,检测到的对照组的荧光蛋白标记的目的抗原阴性细胞的数量为n2,然后根据所述n1和所述n2计算所述adc药物的旁杀伤率,所述adc药物的旁杀伤率=[1-(n1/n2)]
×
100%。
[0008]
根据一些实施方式,根据目的抗原的表达水平,在对adc药物所带的毒素较为敏感的细胞株中,选取抗原阳性和阴性的细胞株分别作为所述目的抗原阳性细胞和所述目的抗原阴性细胞。其中,对毒素较为敏感一般是指ec50 《 10 nm。
[0009]
根据一些优选实施方式,所述adc药物为her2作为目的抗原、dxd作为毒素的药物。进一步优选地,所述adc药物的抗体为曲妥珠单抗。
[0010]
进一步优选地,所述目的抗原阳性细胞为sk-br-3,所述目的抗原阴性细胞为mda-mb-468。
[0011]
根据一些实施方式,所述检测方法还包括确定共培养时所述目的抗原阳性细胞和所述荧光蛋白标记的目的抗原阴性细胞的接种数目比例的步骤,其中根据目的抗原阳性细胞和目的抗原阴性细胞的生长速度确定所述接种数目比例,更具体地,根据目的抗原阳性细胞和目的抗原阴性细胞的生长速度是指将目的抗原阳性细胞和目的抗原阴性细胞按照一定添加比例共培养结束时目的抗原阳性细胞和目的抗原阴性细胞的数目比例为1:2~2:1时所采用的目的抗原阳性细胞和目的抗原阴性细胞的添加比例。
[0012]
根据一些优选实施方式,共培养时,所述目的抗原阳性细胞和所述荧光蛋白标记的目的抗原阴性细胞的接种数目比例为(3~4):1。
[0013]
根据一些实施方式,所述检测方法还包括确定共培养时所述目的抗原阳性细胞和所述荧光蛋白标记的目的抗原阴性细胞的接种总数目的步骤,其中所述接种总数目根据将所述目的抗原阳性细胞和所述荧光蛋白标记的目的抗原阴性细胞共同孵育至融合度达到90~100%时的细胞总数。
[0014]
根据一些优选实施方式,共培养时,所述目的抗原阳性细胞和所述荧光蛋白标记的目的抗原阴性细胞的接种总数目为8000~10000个。
[0015]
根据一些优选实施方式,采用细胞培养板进行所述共培养。
[0016]
根据一些优选实施方式,控制所述共培养的时间为4~7天。
[0017]
根据一些优选实施方式,进行所述共培养时,先将所述目的抗原阳性细胞和所述荧光蛋白标记的目的抗原阴性细胞贴壁培养过夜,然后加入所述adc药物,继续孵育培养。
[0018]
根据一些实施方式,所述检测方法还包括确定共培养时所述adc药物的添加浓度的步骤,其中,所述adc药物的添加浓度为到达所述目的抗原阳性细胞最大杀伤值且对所述目的抗原阴性细胞无生长抑制的adc药物的浓度。
[0019]
根据一些优选实施方式,控制所述adc药物的添加浓度为1~10nm。
[0020]
根据一些实施方式,所述检测方法还包括使用表达荧光蛋白的慢病毒感染所述目的抗原阴性细胞以制得所述荧光蛋白标记的目的抗原阴性细胞的步骤。
[0021]
根据一些优选实施方式,制备所述荧光蛋白标记的目的抗原阴性细胞时,还包括多次使用流式细胞分析仪重复筛选细胞密集且荧光强度集中的细胞进行培养至收集的细胞中荧光蛋白阴性细胞的比例≤2%的步骤,从而使得获得的荧光蛋白标记的目的抗原阴性细胞在传代的过程中可以稳定表达,进而可以无需每次检测旁杀伤率时均需重新制备荧光蛋白标记的目的抗原阴性细胞。
[0022]
根据一些优选实施方式,所述检测方法还包括在进行所述共培养前,对所述目的抗原阳性细胞采用不同于标记目的抗原阴性细胞的荧光蛋白的荧光蛋白进行标记的步骤;以及在所述共培养后,采用荧光细胞计数方法检测荧光蛋白标记的目的抗原阳性细胞的数量,并根据所述数量计算所述adc药物对所述目的抗原阳性细胞的杀伤率的步骤。例如,可以用gfp标记目的抗原阴性细胞,用mcherry、或者rfp标记目的抗原阳性细胞,从而可以用该方法同时观察和检测adc药物的杀伤率和旁杀伤率,也可以在培养的过程中随时观察两种细胞的变化。
[0023]
根据一些实施方式,所述荧光细胞计数方法的具体步骤为:使用多功能酶标仪的细胞成像模块,选择相应的荧光蛋白通道,对共培养后的样品拍照,获得待测细胞的计数结果。
[0024]
根据一些更为具体且优选实施方式,adc药物旁杀伤活性的检测方法,包括如下步骤:1)根据待检测adc药物选取目的抗原阳性细胞株和目的抗原阴性细胞株,确定adc药物的添加浓度;2)确定目的抗原阳性细胞和目的抗原阴性细胞的铺板比例和总数目;3)使用荧光蛋白标记目的抗原阴性细胞;4)将目的抗原阳性细胞和荧光标记的目的抗原阴性细胞按照步骤2)确定的铺板比例和总数目铺板,贴壁培养过夜后,实验组的培养孔中加入adc药物至步骤1)确定的终浓度,对照组加入相同体积但不含adc药物的培养基;实验组和对照组均孵育培养4~7天;5)采用荧光细胞计数方法分别检测步骤4)培养结束后的实验组和对照组中的荧光蛋白标记的目的抗原阴性细胞的数量,其中,检测到的实验组的荧光蛋白标记的目的抗原阴性细胞的数量为n1,检测到的对照组的荧光蛋白标记的目的抗原阴性细胞的数量为n2,然后根据所述n1和所述n2计算所述adc药物的旁杀伤率,所述adc药物的旁杀伤率=[1-(n1/n2)]
×
100%。
[0025]
本技术中细胞的接种总数目、接种比例以及adc药物的添加浓度均按照单孔计量。
[0026]
由于上述技术方案运用,本发明与现有技术相比具有下列优点:本发明利用基于细胞成像的荧光细胞计数方法来检测adc药物的旁杀伤活性,操作过程简单,通量高,一致性好。
附图说明
[0027]
图1为不同代次mda-mb-468-gfp稳转细胞株中gfp表达结果;图2为her2-dxd 在sk-br-3细胞上的增值抑制结果;图3为her2-dxd 在mda-mb-468细胞上的增值抑制结果;图4为不同细胞比例共培养的旁杀伤结果;
图5为不同细胞铺板数量旁杀伤结果;图6为荧光细胞计数检测旁杀伤效果的结果图;图7为荧光强度检测旁杀伤效果的结果图;图8为荧光素酶活性(化学发光)检测旁杀伤效果的结果图;图9为荧光细胞计数检测旁杀伤效果重复性的结果图。
具体实施方式
[0028]
本发明的说明书中公开了所有特征,或公开的所有方法或过程中的步骤,除了相互排斥的特征或步骤以外,均可以以任何方式组合。下面结合具体实施例对本发明的技术方案作进一步的描述,但本发明不应限于这些实施例,除非特别叙述,均可被其他等效或具有类似目的的替代特征加以替换。除非特别叙述,每个特征只是一系列等效或类似特征中一个例子而已。在本发明中所使用的术语,除非另有说明,一般具有本领域普通技术人员通常理解的含义。
[0029]
流式检测法步骤繁琐,很难同时处理大量样本,无法实现高通量检测,为了克服流式检测法的不足,发明人想到了利用荧光检测方法来检测adc药物的旁杀伤效应。旁杀伤效应检测的是目的抗原阴性细胞(即为gfp阳性细胞)杀死或者减少的比例,理论上能够以gfp阳性的细胞的总个数,或者总的gfp的荧光强度作为检测指标,且两种检测方法结果应一致;或者将荧光素酶(luciferase,luc)与gpf同时在目的抗原阴性细胞中表达,将荧光素酶的活性的降低程度作为评价杀死或者减少目的抗原阴性细胞的比例的指标。理论上,三种检测方法的旁杀伤结果应一致。
[0030]
而发明人在通过一系列实验研究确定了针对trastuzumab-dxd的细胞株、adc药物浓度、细胞铺板比例和数量的基础上,对上述三种检测方法进行了进一步研究,具体设计如下三个方案:方案一:使用细胞成像设备和软件(例如biotek cytation3/5, evos fl auto 2等),进行基于细胞成像的荧光细胞计数,检测gfp阳性的细胞数量,根据药物组中mda-mb-468-gfp细胞的数量与对照孔中该细胞数量的比例,计算旁杀伤的效果。细胞旁杀伤率采用如下公式进行计算:细胞旁杀伤率=[1-(实验组gpf阳性细胞数/对照组gpf阳性细胞数)]
×
100%。
[0031]
方案二:使用细胞成像设备或者酶标仪(例如biotek cytation3/5, biotek synergy h1和spectramax m5等),检测gfp荧光强度,根据药物组中mda-mb-468-gfp细胞的荧光强度与对照孔中该细胞荧光强度的比例,计算旁杀伤的效果。细胞旁杀伤率采用如下公式进行计算:细胞旁杀伤率=[1-(实验组gfp荧光强度/对照组gfp荧光强度)]
×
100%。
[0032]
方案三: 制备mda-mb-468-luc-gfp细胞(在mda-mb-468细胞中同时稳定表达荧光素酶和gfp),加入含有荧光素(luciferin)为底物的荧光素酶活性检测试剂(例如steady-lumi萤火虫萤光素酶报告基因检测试剂盒),使用多功能酶标仪(例如biotek synergy h1和spectramax m5等)检测冷发光,gain设置为200,与对照孔冷发光强度相比,将减少的荧光强度作为阴性细胞杀伤的指标。所述细胞旁杀伤率采用如下公式进行计算:细胞旁杀伤率=[1-(实验组冷发光强度/对照组冷发光强度)]
×
100%。
[0033]
虽然理论上三种检测方法的检测结果应当一致,但发明人发现,仅基于细胞成像的荧光细胞计数不仅与流式细胞检测法的结果基本一致,而且具有较好的量效依赖关系和对药物强度(dar值)变化的反应能力。
[0034]
下面结合实施例对本发明作进一步描述。但本发明并不限于以下实施例。实施例中采用的实施条件可以根据具体使用的不同要求做进一步调整,未注明的实施条件为本行业中的常规条件,例如未注明的细胞培养条件、培养基等为常规条件和常规培养基。本发明各个实施方式中所涉及到的技术特征只要彼此之间未构成冲突就可以相互组合。
[0035]
实施例11. mda-mb-468-gfp稳转细胞株的构建1)gfp表达慢病毒由金斯瑞提供。
[0036]
2)day1接种细胞:取融合度为70%-80%,生长状态良好的mda-mb-468,消化,计数,接种1.5
×
106细胞培养于t25瓶中,l15完全培养基(含10%fbs)培养细胞,培养体积为6ml,放置细胞培养箱中过夜培养;3)day2:配置l15完全培养基(含10%fbs)和聚凝胺(ploybrene)混合物,ploybrene终浓度为10 μg/ml。感染前,从冰箱取出并置于冰上融化病毒,吸去细胞原有培养基,加入4ml培养基/ploybrene混合物,再将病毒原液加入细胞中,病毒与细胞数量的比值(moi)为5。
[0037]
4)day3:感染24h后,吸去含病毒的培养液,换上新鲜的完全培养液,继续37℃培养;5)观察细胞状态,扩大培养:继续培养24h,用荧光显微镜观测gfp表达效率,并将细胞从t25转入t75培养瓶中培养;6)流式分选:感染72h后,细胞计数、70 μm滤膜过滤、1ml pbs重悬(细胞数不大于1
×
107),收集阳性细胞中荧光强度跨度小且细胞最密集的部分,大约在阳性细胞群的50%-60%阳性区,收集培养至总细胞数为5
×
107。经facs检测后,若阴性细胞比例>2%,重复用流式细胞分选的方法筛选细胞较密集的荧光强度集中的gfp阳性细胞,直至阴性细胞比例≤2%;7)分选后的细胞即为用于旁杀伤实验中的阴性肿瘤细胞,该细胞命名mda-mb-468-gfp。在细胞传代保存过程中检测gfp是否稳定表达,检测结果如图1所示,该稳转细胞株在10代内稳定表达gfp,其中,图1中的灰色阴影部分为阴性对照(没有表达荧光的mda-mb-468细胞)。
[0038]
2. 确定旁杀伤药物浓度范围1)分别取融合度约80%,生长状态良好的sk-br-3和mda-mb-468-gfp,铺板。细胞过夜贴壁之后,检测enhertu,即trastuzumab-dxd(8)(药物/抗体比率dar值约为8,以下以her2-dxd表示)在肿瘤细胞上的增值抑制作用。
[0039]
2)检测的药物浓度设置:最高检测的药物浓度为200 nm,进行连续5倍梯度稀释,共稀释10个梯度。
[0040]
3)在37 ℃培养箱内孵育120 h后,celltiter-glo发光法细胞活力检测试剂盒(ctg法)检测药物对肿瘤细胞的增殖抑制作用。细胞活力计算公式:viability=(rlu(x)-rlu(puro))/(rlu(control)-rlu(puro))
×
100%,结果根据4-参数虚拟方程进行计算,利用
prism 8软件进行绘图,计算出ic50 值。其中rlu(x)为药物处理孔的读值,rlu(control)为不加药对照孔的读值,rlu(puro) 为细胞全部死亡时的基线读值。实验结果如图2和图3所示。
[0041]
4)旁杀伤药物浓度选择原则:在阳性细胞上能达到最大杀伤但在阴性细胞上无增殖抑制作用,根据ctg结果可选择的旁杀伤药物浓度最高为10 nm。
[0042]
3. 确定细胞铺板比例和数量3.1 确定细胞铺板比例1)取生长状态良好的sk-br-3和mda-mb-468-gfp细胞,消化,台盼蓝染色计数,按sk-br-3:mda-mb-468-gfp =4:1、2:1、1:1的比例分别混合,接种于96孔板中,每孔细胞总量为10 000,在37℃、5%co2细胞培养箱中过夜培养;2)加入adc药物,使其终浓度为10 nm,37℃、5% co2细胞培养箱中培养120 h。
[0043]
3)细胞成像的荧光细胞计数方法检测:
①
使用cytation3多功能酶标仪的细胞成像模块,gfp通道拍照,调整聚焦和曝光时间,参数设置为led:10、integration time:665、gain:15.6,应用于所有样品孔;拍照模式为montage,拍照视野选择4*4,即每个样品孔拍16帧。运行该程序。
[0044]
②
拍照完成后,选中其中一个样品孔图片分析,优选对照组,做gfp通道荧光细胞计数分析。设置参数threshold选择auto并设置值为18、细胞大小设置5-100 μm,应用于所有孔,导出细胞计数结果,根据药物组中 mda-mb-468-gfp细胞的数量与对照孔中该细胞数量的比例,计算旁杀伤的效果。结果如图4所示,4:1的细胞共培养比例显示出更好的旁杀伤效果,故选择sk-br-3与mda-mb-468-gfp共培养比例为4:1。
[0045]
3.2 确定细胞铺板数量1)取生长状态良好的sk-br-3和mda-mb-468-gfp细胞,消化,台盼蓝染色计数,按sk-br-3:mda-mb-468-gfp =4:1比例混合,接种于96孔板中,每孔细胞铺板总数为8000或者10 000, 37℃、5%co2细胞培养箱中过夜培养;2)加入adc药物,使其终浓度为10 nm ,37℃ 5%co2细胞培养箱中培养120h。
[0046]
3)细胞成像的荧光细胞计数方法检测与3.1一致。结果如图5所示,每孔铺板细胞总数量为8000和10000时,10 nm adc药物对mda-mb-468-gfp细胞的旁杀伤效果无明显差异,本发明中选用每孔10000个细胞进行后续实验。
[0047]
3.3重复性实验按照以下方案进行三组平行实验:1)取生长状态良好的sk-br-3和mda-mb-468-gfp细胞,消化,台盼蓝染色计数,按sk-br-3:mda-mb-468-gfp =4:1比例混合,接种于96孔板中,每孔细胞铺板总数为10 000, 37℃、5%co2细胞培养箱中过夜培养;2)加入adc药物,使其终浓度为10 nm ,37℃ 5%co2细胞培养箱中培养120h。
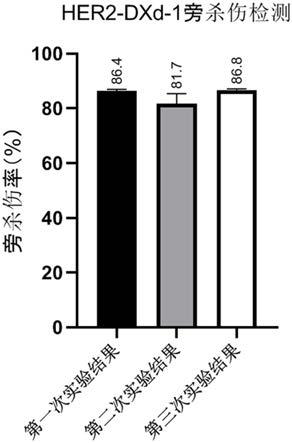
[0048]
3)细胞成像的荧光细胞计数方法检测与3.1一致。结果如图9所示,从结果可见,各组的检测结果的一致性较好。
[0049]
实施例2为比较荧光细胞计数法、荧光强度法和化学发光法检测旁杀伤的效果,使用类似制备mda-mb-468-gfp的方法,制备mda-mb-468-luc-gfp。
[0050]
(1)取生长状态良好的sk-br-3和mda-mb-468-luc-gfp细胞,消化,台盼蓝染色计数,调整细胞密度至1
×
105cells/ml,按sk-br-3:mda-mb-468-luc-gfp=4:1比例混合,100 μl每孔铺96孔板中,37℃、5%co2细胞培养箱中过夜培养;(2)配置adc药物,最高检测浓度为10 nm,10倍梯度稀释,共检测3个浓度,即10nm、1nm、0.1nm;(3)按照每孔100 μl 含不同浓度药物的培养基加入含细胞的96孔板中,37℃、5%co2细胞培养箱中培养120h。
[0051]
(4)不同检测方法(4.1)细胞成像设备检测旁杀伤 (检测参数与实施例1的细胞成像的荧光细胞计数方法相同)。结果如图6所示,1 nm和10 nm显示出较强的旁杀伤效果,可以作为后续评估所用的浓度。
[0052] (4.2)荧光强度法检测旁杀伤效果使用cytation3多功能酶标仪的fluorescence模块,设置gfp荧光通道的激发波长和最大发射波长,既488nm和525nm,gain设置为100,读取每孔细胞gfp荧光强度,导出结果,根据药物组中mda-mb-468-luc-gfp细胞荧光强度与对照孔中该细胞荧光强度的比例,计算旁杀伤率。结果如图7所示,该方法与本发明方法的旁杀伤结果趋势一致,但旁杀伤率显著低于本发明方法,不能真实反映adc旁杀伤效应。
[0053] (4.3) 化学发光方法检测:使用cytation3多功能酶标仪的luminescence模块,设置gain值为200,检测化学发光,导出结果,根据药物组中mda-mb-468-luc-gfp细胞化学发光强度与对照孔中该细胞的化学发光强度的比例,计算旁杀伤率。结果如图8所示,荧光细胞计数方法即本发明方法与荧光素酶活性检测法的旁杀伤结果相似,但其量效依赖关系优于荧光素酶活性检测法。
[0054]
对比例1将her2阳性的sk-br-3 和 her2阴性的mda-mb-468 细胞按照4:1比例混合,2.5ml每孔铺6孔板中(每孔共含2.5
×
105个细胞),37℃、5%co2细胞培养箱中过夜培养,然后加入her2-dxd 10 nm,继续培养5天。培养结束后,消化收集细胞,细胞用fitc标记的抗her2抗体染色,洗涤,再用流式细胞仪分析fitc阳性和阴性的细胞比例,再根据细胞总数计算各组中fitc阳性和阴性细胞的绝对值。fitc阳性细胞为her2阳性细胞sk-br-3,fitc阴性细胞为her2阴性细胞mda-mb-468。该方法的检测结果见表1,该方法检测的旁杀伤率为74.46%。
[0055]
而本技术实施例2中使用荧光细胞计数方法该药物在10 nm作用下的旁杀伤效率为78.62%。可见本发明中的检测方法与第一三共株式会社的旁杀伤检测结果一致,且表现出操作过程简单,通量高,一致性好等优势。
[0056]
实施例3
为进一步比较不同方法检测的旁杀伤效果,我们选用trastuzumab-dxd(4)(药物/抗体比率dar值约为4,以下以her2-dxd-2表示)为受试adc。
[0057]
(1)取生长状态良好的sk-br-3和mda-mb-468-luc-gfp细胞,消化,台盼蓝染色计数,调整细胞密度至1
×
105cells/ml,按sk-br-3:mda-mb-468-luc-gfp=4:1比例混合,100 μl每孔铺96孔板中,37℃、5%co2细胞培养箱中过夜培养;(2)配置adc药物,检测浓度为10 nm;(3)每孔100 μl含药物的培养基加入含细胞的96孔板中,37℃、5%co2细胞培养箱中培养120h。
[0058]
(4)采用的旁杀伤检测方法为上述实施例2中提及的三种方法,以及经典的流式细胞检测法,其中经典的流式细胞检测法与对比例1基本相同,区别仅在于adc药物替换为her2-dxd-2。
[0059]
各方法的检测结果如表2所示,与荧光强度检测法或者荧光素酶活性的检测方法相比,本发明方法,即荧光细胞计数法与经典的流式细胞检测法的结果更为接近。
[0060]
根据对上述两个测试物的检测结果显示,本发明中的荧光细胞计数法与经典的流式细胞检测法的结果一致,并且显示了较好的量效依赖关系和对药物强度(dar值)变化的反应能力。相比之下,荧光素酶法检测结果敏感性和量效依赖关系低于本发明方法和流式法。荧光强度法检测法虽然原理上与本发明方法最为接近,但却无法有效检测旁杀伤作用,可能因为药物对细胞杀伤后,荧光蛋白的释放到胞外造成较高的背景。
[0061]
以上对本发明做了详尽的描述,其目的在于让熟悉此领域技术的人士能够了解本发明的内容并加以实施,并不能以此限制本发明的保护范围,凡根据本发明的精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围内。
