一种猪伪狂犬病病毒gi/ge双基因缺失株及其应用
技术领域
1.本发明属于病毒学基因工程技术和预防兽医学技术领域,特别涉及一种猪伪狂犬流行变异病毒的gi/ge双基因缺失毒株,并进一步公开其构建方法,以及该基因缺失毒株的应用。
背景技术:
2.猪伪狂犬病是伪狂犬病病毒(pseudorabies virus,prv)引起的一种以发热、瘙痒、脑延髓炎等为特征的重要传染病,是当前危害养猪业的最为严重的传染病之一,在世界范围内广泛流行,每年给世界养猪业造成巨大的经济损失。猪的伪狂犬病在我国广泛存在且危害严重,是制约规模化猪场生产的主要疫病之一。它能引起妊娠母猪流产、死胎 或木乃伊胎和仔猪出现神经症状、麻痹,死亡率高。2011年以来全国多个省份使用传统毒株弱毒疫苗免疫的猪场出现了母猪产弱仔、死胎、流产,仔猪出现神经症状及死亡等疑似伪狂犬的临床症状并产生严重的经济损失。
3.目前,治疗猪伪狂犬病最常用的是中药、抗病毒西药、抗菌药以及免疫疫苗,中药由于其组方不合理或只是简单的粉碎,且粒径过大,药物释放较慢,导致其生物利用度较低,临床效果并不理想;抗菌药由于有药物残留和易于产生耐药性,使用受到严格限制;而各种抗病毒药如利巴韦林、金刚烷胺等农业部已经禁止使用;因此,免疫疫苗成为了预防猪伪狂犬病的主要手段。但是,随着病毒的不断变异,当前市场上流通的猪伪狂犬传统疫苗株已经不能很好的保护猪伪狂犬变异株的攻击。因此,必须构建以变异毒株为基础的疫苗侯选株,才能有效的抵御prv变异株侵袭。
技术实现要素:
4.本发明提供了一种猪伪狂犬病病毒gi/ge双基因缺失株,该基因缺失毒株不仅可用于当前伪狂犬病的防控,而且可结合野毒感染检测技术,应用于伪狂犬病毒的净化工作;本发明所要解决的第二个技术问题在于提供上述基因缺失株的构建方法及其应用。
5.为实现上述目的,本发明提出了一种猪伪狂犬病病毒gi/ge双基因缺失株,所述病毒株在猪伪狂犬病毒野生型强毒株prv-e6株的基础上缺失gi/ge双毒力基因。
6.具体的,所述病毒株的gb、gc、tk基因序列分别如seq id no.1-3所示。
7.具体的,所述病毒株的分类命名为伪狂犬病毒,保藏于中国微生物菌种保藏管理委员会普通微生物中心,简称cgmcc,保藏地址位于北京市朝阳区北辰西路1号院3号,保藏编号为cgmcc no.22108,保藏日期为2021年8月19日。
8.本发明还公开了一种构建所述猪伪狂犬病病毒gi/ge双基因缺失株的方法,包括如下步骤:(1)分别设计并构建具有如下序列结构的靶向载体gi psgrna1和ge psgrna2:gi sgrna1-f:accgcctcctcgccgccctgaccctgg;
gi sgrna1-r:aaacccagggtcagggcggcgaggagg;ge sgrna2-f:accgcctcaacggcgacgaccgccgcg;ge sgrna2-r:aaaccgcggcggtcgtcgccgttgagg;(2)将所述靶向载体gi psgrna1、ge psgrna2和所述猪伪狂犬病毒野生型强毒株prv-e6病毒共转染伪狂犬病毒易感细胞;(3)pcr鉴定纯化噬斑。
9.具体的,所述易感细胞包括pk-15、vero、marc-145或bhk-21中的至少一种。
10.本发明还公开了所述猪伪狂犬病病毒gi/ge双基因缺失株用于制备猪伪狂犬病疫苗的用途。
11.具体的,所述疫苗包括活疫苗、灭活疫苗或活载体疫苗。
12.本发明还公开了一种猪伪狂犬病疫苗,由所述猪伪狂犬病病毒gi/ge双基因缺失株制备得到。
13.本发明还公开了一种制备所述猪伪狂犬病疫苗的方法,包括如下步骤:(1)采用易感细胞纯培养所述猪伪狂犬病病毒gi/ge双基因缺失株;(2)辅以冻干保护剂或/和其它免疫佐剂分装后冻干,得到所需活疫苗;或者,(1)采用易感细胞纯培养所述猪伪狂犬病病毒gi/ge双基因缺失株;(2)灭活,辅以选定佐剂乳化,得到所需灭活疫苗;或者,(1)向所述伪狂犬病病毒gi/ge双基因缺失株的其它非必须基因位置,用同源重组或基因编辑的方法插入其它外源基因表达框,构建成表达载体;(2)采用易感细胞纯培养该伪狂犬病病毒gi/ge双基因缺失株表达载体;(3)辅以冻干保护剂或/和其它免疫佐剂分装后冻干,得到所需活载体疫苗。
14.具体的,其它外源基因包括但不限于猪瘟病毒e2蛋白、猪蓝耳病毒gp5蛋白、猪流行性腹泻病毒s1蛋白等。
15.本发明所述猪伪狂犬病毒基因缺失毒株prv-e6
‑△
ge/gi,其母本为由病料中独立分离的野生型流行变异毒株prv-e6,在变异毒株prv-e6株的基础上,采用一种独特简化的一步双敲除技术,敲除了gi/ge双毒力基因获得。该毒株gb、gc、tk基因带有2012年后新出现的流行变异强毒株的进化特征,具有增殖滴度高、毒力强(对小鼠的半数致死量为10
3.3
tcid
50
,使2-3周龄仔猪发病剂量为10
5 tcid
50
)的优势。该基因缺失毒株不仅可用于当前伪狂犬病的防控,而且可结合野毒感染检测技术,应用于伪狂犬病毒的净化工作,具有广阔的市场前景。
16.本发明所述猪伪狂犬病疫苗,由本发明所述猪伪狂犬病毒基因缺失毒株prv-e6
‑△
ge/gi按照常规方法制备,其灭活疫苗免疫仔猪,表现出良好的安全性和免疫原性,可用于流行性猪伪狂犬病的预防。
17.本发明所述猪伪狂犬病毒基因缺失毒株prv-e6
‑△
ge/gi的构建方法,采用简单独特的一步双敲除方法,与其它采用构建含有标记基因(如:egfp等)和同源臂结构的打靶质粒、再通过筛选中间或过渡病毒、最后敲除过渡病毒标记基因的方法相比,具有操作更简便、更直接和更高效的优势。
附图说明
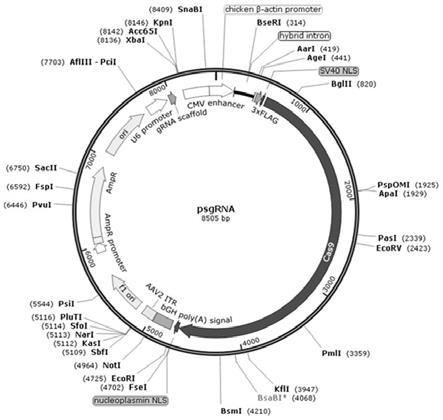
18.图1为打靶质粒psgrna的结构示意图;图2为基因缺失区(含gi/ge)pcr鉴定结果;其中,m:marker,1-3: psgrna质粒和prv共转后的3组细胞培养物;图3为第一次噬斑纯化pcr鉴定结果;其中,m:marker,1-11:第一次蚀斑纯化后的11个克隆,c:阴性对照;图4为第二次噬斑纯化pcr鉴定结果;其中,m:marker,1-9:第二次蚀斑纯化后的9个克隆;图5为第三次噬斑纯化pcr鉴定结果;其中,m:marker,1-7:第三次蚀斑纯化后的7个克隆;图6为prv-e6
‑△
ge/gi株与其亲本株prv-e6株的gb基因pcr鉴定结果;其中,m:marker,1:prv-e6
‑△
ge/gi株,2:prv-e6株;图7为prv-e6
‑△
ge/gi株ge蛋白免疫荧光鉴定结果;其中,a、b:e6株,c、d:prv-e6
‑△
ge/gi株;图8为缺失序列在prv基因组中的位置以及缺失后核苷酸序列测定结果;图9为prv-e6
‑△
ge/gi株ge蛋白western blot鉴定结果;其中,m:marker,1:prv-e6株,2:prv-e6
‑△
ge/gi株;图10为免疫组和对照组攻毒后14日体温变化结果;图11为免疫组和对照组免疫后14日和35日中和抗体滴度结果。
具体实施方式
19.为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图和具体实施方式对本发明作进一步详细的说明。
20.实施例1猪伪狂犬病毒流行变异强毒株(prv-e6)株分离鉴定采用常规pcr方法对来自黑龙江、河南和山西收集的疑似伪狂犬病猪的病料进行prv-ge基因检测,将检测结果为阳性的病料研磨和过滤除菌后,接种bhk-21细胞进行病毒分离,共获得3株prv病毒,分别命名为prv-hlj2012、prv-sx2012和prv-hn2012。
21.将病毒增殖滴度较高的prv-sx2012株在bhk-21细胞上进一步亚克隆,筛选到一个克隆毒株命名为prv-e6。对该克隆毒株的gb、gc、ge和tk基因分子流行病学调查结果表明,prv-e6带有我国2011-2012年新出现的变异毒株的进化特征。毒力试验结果也表明,prv-e6株以2ml
×
10
6 tcid
50
/ml滴鼻接种试验猪,表现出明显的临床症状,高热41℃以上,精神沉郁、食欲降低、呼吸困难或神经症状,可使14-21日龄仔猪5/5发病死亡。
22.实施例2猪伪狂犬病毒gi/ge双基因缺失株(prv-e6
‑△
ge/gi株)构建sgrna序列设计及重组载体构建参照发表在genbank的prv全基因组序列,设计合成如下序列结构的sgrna,分别记为gi sgrna1和ge sgrna2:gi sgrna1-f:accgcctcctcgccgccctgaccctgg;gi sgrna1-r:aaacccagggtcagggcggcgaggagg;ge sgrna2-f:accgcctcaacggcgacgaccgccgcg;
gesgrna2-r:aaaccgcggcggtcgtcgccgttgagg。
23.打靶质粒构建通过常规退火和磷酸化修饰,将所述毒株插入到gisgrna1和gesgrna2载体的bbsi酶切位点(见图1),构建成打靶质粒。
24.质粒酶切,反应体系包括:psgrna质粒1μg;bbsi1μl;10xbuffer2.2μl去离子水补至20μl;于37℃进行酶切2h,跑胶并回收。
25.所述oligos的磷酸化修饰与退火体系包括:oligo1(100μm)1μ;oligo2(100μm)1μl;10xt4ligationbuffer(neb)1μl;t4pnk(neb)0.5μl;去离子水补至10μl;于37℃处理30min,95℃处理5min,按照每分钟降低5℃最后降至25℃。
26.所述oligos与酶切后的载体连接体系包括:磷酸化退火后的oligos1μl;psgrna50ng;10xneb连接酶buffer2μl;neb连接酶1μl;去离子水补至10μl;于室温下连接30min,进行转化,挑取克隆,测序正确的进行下一步。
27.质粒提取参照质粒提取试剂盒提取质粒,-20℃冻存备用。
28.转染按照标准的转染方法(ltx或transfectamine2000)转染打靶质粒,转染后24小时以0.01moi感染prv-e6株。连续观察3-5日,待出现明显的细胞病变时收获细胞培养物。
29.噬斑纯化将收集的细胞培养物进行10-3
和10-4
倍稀释,分别接种到已经长成单层的6孔细胞培养板,37
°
c吸附2小时,弃掉病毒液;将2%的低熔点琼脂糖溶液(42℃保存)与2
×
细胞维持液(42℃保存)按1:1的比例混匀后,加入各培养孔中,2ml/孔,冷却后凝固成覆盖层;倒置培养板,37
°
c,5%co2培养;连续观察3-4日,等出现明显的噬斑时,分别收集噬斑(使用1ml的蓝色枪头,提前剪掉尖端部位,然后用移液器吸取蚀斑),重复以上步骤3次,以获得单一克隆毒株,记为prv-e6
‑△
ge/gi株,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号cgmccno.22108,保藏地址:北京市朝阳区北辰西路1号院3号。
30.实施例3prv-e6
‑△
ge/gi株的基因鉴定gi/ge基因pcr鉴定
将细胞培养物,接种bhk-21单层细胞,待出现明显病变时,收获细胞上清。取出50μl稀释到200μl,抽提dna进行pcr鉴定。
31.设计pcr鉴定引物序列如下:f:5
’‑
gcgtgtgcgtctacatcttct-3’;r:5
’‑
ggtatttaagcggggcgggcat-3’。
32.pcr反应体系(50μl):2
×
gc buffer 25μl,dntp mixture 5μl,上下游引物各2μl,prime star 0.5μl,dna模板 2μl,h2o 13.5μl。
33.pcr反应条件:94℃预变性1分钟;98℃变性10秒、56℃退火15秒,72℃延伸3秒,共35个循环;72℃延伸5分钟。
34.共转后的细胞培养物,经过pcr鉴定,发现1号出现明显的剪切带,敲除基因大小为2000bp以上(如图2所示)。
35.经过一次噬斑纯化,共筛选到11个噬斑,经过pcr鉴定,结果如附图3所示,发现仅有7号样含有缺失后的基因片段,但仍有明显的杂带,表示仍然不够纯净,需要进一步纯化。
36.经过第二次噬斑纯化,结果如附图4所示,获得3号、4号单一条带的克隆,表明收获的细胞培养物中含有单一的病毒克隆,显示较纯净。
37.经过第三次噬斑纯化的结果如图5所示。
38.将上述筛选到的prv-e6
‑△
ge/gi株的gi/ge基因pcr扩增产物连接peasy-blunt载体,送样测序列,比对基因缺失区的准确位置,测序结果如序列seq id no.4所示,比对结果如图6所示,可见,缺失序列在基因组上的位置位于us6基因的终止密码子之后,包含全长的gi基因和ge基因的前999bp序列。
39.基因pcr鉴定具体的操作方法同前述gi/ge基因 pcr鉴定步骤。
40.设计如下序列结构的gb特异性引物:f:5
’‑
cgggcccgctgttcttcttg-3’;r:5
’‑
tggcggttgcagtcttcaggtc-3’。
41.分别对prv-e6
‑△
ge/gi株和prv-e6株的gb基因进行pcr扩增,结果如图7所示。可见,prv-e6
‑△
ge/gi株的gb基因与其亲本株prv-e6株大小一致,表明gb基因没有因敲除gi/ge基因而受到影响。
42.经鉴定,本发明所述病毒株的gb、gc、tk基因序列分别如seq id no.1-3所示。
43.实施例4 prv-e6
‑△
ge/gi株的性能鉴定间接免疫荧光鉴定取bhk-21细胞按1:5消化传代,2ml/孔滴加到含有盖玻片的六孔板中,置37℃、5%co2的恒温培养箱中培养,待生长至80%融合时,0.01moi接种prv-e6
‑△
ge/gi株,继续培养2日;收集细胞并固定染色,操作步骤如下:弃培养基上清,加入冷pbs 1ml轻轻润洗1次,弃洗液;以80%冷丙酮室温固定细胞6-8分钟,然后以冷pbs洗3次,每次5分钟,再以含有2% bsa的pbs(封闭液)孵育30分钟;孵育prv ge单克隆抗体,以含有2% bsa的pbs稀释一抗,轻轻加入100μl稀释后一抗,室温孵育60分钟;以pbs洗涤3次,每次5分钟;以含有2% bsa的pbs稀释二抗,轻轻加入100μl稀释后二抗,室温孵育60分钟;以pbs洗涤3次,每次5分钟。荧光显微镜下观察拍照,结果如图8所示,亲代毒株prv-e6感染细胞后用ge单克隆抗体可检测到特异绿色
荧光。而prv-e6
‑△
ge/gi株则在感染细胞后用ge单克隆抗体检测不到特异的荧光。表明,prv-e6
‑△
ge/gi株感染细胞内ge蛋白缺失表达。
44.鉴定将prv-e6
‑△
ge/gi和prv-e6分别按0.1%体积比例感染bhk-21细胞,12小时后收集细胞加入ripa裂解后再经超声裂解,离心收集蛋白。然后按蛋白样品的体积加入适量的上样缓冲液,混匀后沸水煮5分钟,瞬时离心后上样。60v电泳30分钟,100v电泳90分钟,转膜,将滤纸、胶、膜、滤纸按顺序放好,在100v的电压下于冰上转膜2小时,封闭2小时;用pbst洗涤5次,每次3分钟,室温孵育一抗2小时;pbst洗涤5次,每次3分钟,洗涤后孵育二抗,pbst洗涤5次,每次3分钟,洗涤后显色,结果如图9所示,prv-e6感染细胞可检测到ge蛋白条带,而prv-e6
‑△
ge/gi感染细胞则检测不到相应条带。表明prv-e6
‑△
ge/gi株的ge蛋白缺失。
45.实施例5 prv-e6
‑△
ge/gi株的免疫原性测试将上述prv-e6
‑△
ge/gi接种bhk-21细胞,收获细胞培养液制备灭活疫苗。
46.用2-3周龄健康易感仔猪10头,分为2组,每组5头。第1组,每头分别肌肉接种疫苗2.0ml,首免后14日以相同剂量和途径进行二免;第2组为对照组不接种疫苗,各组猪相同条件下隔离饲养。
47.首免后14日和二免后21日,采集血清做中和抗体滴度检测,比较免疫组与对照组中和抗体滴度情况,采血后滴鼻攻毒2ml
×
10
6 tcid
50
/ml,观察临床表现及症状,监测体温。体温监测记录结果如图10所示,中和抗体滴度检测结果如图11所。
48.免疫攻毒保护结果见下表1,可见在观察期结束后,免疫prv-e6
‑△
ge/gi组实验猪获得了完全保护,而攻毒对照组试验猪全部发病,表现为攻毒后高热41℃以上,精神沉郁、食欲降低、呼吸困难或神经症状,3/5最后死亡。该试验表明,以prv-e6
‑△
ge/gi株制备的灭活疫苗,对流行变异强毒株的攻击,可以使免疫猪获得100%的保护,具有良好的安全性和免疫原性,适合于对流行变异毒株的防控。
49.表1免疫攻毒保护率注:“/”表示未进行此项实施例6将实验室产品(批号201701)与西班牙海博莱生物大药厂的猪伪狂犬病灭活疫苗(barthak61株)分别接种2-3周龄健康仔猪,进行安全性、效力和免疫持续期的比较。
50.1、安全性比较试验选取2-3周龄健康仔猪共15头,随机分为3组,每组5头。第1组注射实验室制品201701批,颈部肌肉注射1次,4.0ml/头;第2组注射西班牙海博莱生物大药厂产品1q85-1批,颈部肌肉注射1次,4.0ml/头;第3组为对照组,不注射疫苗。各组试验猪同条件下隔离饲养,观察14日,记录试验猪的临床表现、体温、局部和全身反应。试验分组情况见表2。
51.表2安全性比较试验分组情况表
注:“/”表示未进行此项。
52.免疫后每日观察并记录试验猪的临床表现,包括精神状态、行为活动、呼吸状况、采食状况和粪便状况,连续观察14日,记录临床表现状况于下表3。
53.在免疫当日、免疫后4小时及免疫后1-10日测量并记录试验猪的直肠温度,测试结果见下表4。
54.每日早晚各1次观测试验猪注射局部和全身有无不良反应,连续观测14日,记录结果见下表5。
55.表3安全性比较试验中临床表现结果从上表结果可以看出,在试验期内,实验室制品、西班牙海博莱产品免疫试验猪后,所有试验猪精神状态良好,行为、呼吸、采食、粪便均正常,与健康对照组无明显差异。
56.表4安全性比较试验中体温测定结果
从上表结果可以看出,在观察期内,实验室制品、西班牙海博莱产品免疫试验猪后,试验猪体温没有明显变化,仅个别猪体温出现升高至40℃以上,但次日便可自行恢复,未影响猪精神状态和食欲。各试验组的体温与健康对照组无明显差异。
57.表5安全性比较试验中局部和全身反应观察结果从上表结果可以看出,在试验期内,实验室制品、同类产品免疫试验猪后,所有试验猪的注射部位均未见异常,未出现全身反应。
58.可见,在安全性试验中,各免疫组试验猪精神状态、行为、采食等均正常,体温也无明显变化,表明本制品和同类产品均具有良好的安全性。
59.2、疫苗效力比较试验选取2-3周龄健康仔猪共15头,随机分为3组,每组5头。第1组注射实验室制品201701批,颈部肌肉注射疫苗2.0ml,14日后用相同剂量加强免疫1次,第2组注射西班牙海博莱生物大药厂产品1q85-1批,颈部肌肉注射疫苗2.0ml,14日后用相同剂量加强免疫1次;第3组为攻毒对照组,不注射疫苗,各组隔离饲养。二免后21日,采血,测定中和抗体效价,采血后攻毒,除空白对照组外,对所有试验猪各滴鼻接种猪伪狂犬病病毒检验用强毒e6株2ml
(含10
6.0 tcid
50
/ml),各组试验猪同条件下隔离饲养观察至14日,试验分组情况见下表6。
60.表6疫苗效力比较试验分组情况表注:“/”表示未进行此项。*病毒含量为(10
6.0 tcid
50
/ml)。
61.按现行《中国兽药典》附录“3406 中和实验法”采用固定病毒稀释血清法对prv中和抗体效价进行测定,测试的疫苗效力比较结果见下表7。
62.表7疫苗效力比较试验结果注:“/”表示未进行此项。
63.从上表结果可以看出,疫苗效力比较试验结果为201701批制品免疫组试验猪中和抗体效价均不底于1:16,攻毒后获得5/5保护,而同类制品免疫组试验猪中和抗体效价2/5低于1:16,攻毒后获得3/5保护,对照组5/5发病。表明本实验室制备的猪伪狂犬病病毒基因缺失灭活疫苗(prv-e6
‑△
ge/gi株)具有更好的免疫效果,明显优于同类制品。
64.可见,在效力检验中,免疫后35日,用prv e6株攻毒,实验室制品免疫组获得5/5保护,而同类产品则获得3/5保护,攻毒对照组5/5发病。
65.3、免疫持续期比较试验
选取2-3周龄健康仔猪共15头,随机分为3组,每组5头。第1组注射实验室制品201701批,颈部肌肉注射疫苗2.0ml,14日后用相同剂量加强免疫1次;第2组注射西班牙海博莱生物大药厂产品1q85-1批,颈部肌肉注射疫苗2.0ml,14日后用相同剂量加强免疫1次;第3组为攻毒对照组,不注射疫苗,各组隔离饲养。免疫后35日、2个月、3个月、4个月和5个月,采血,测定血清中和抗体效价,采血后攻毒,除空白对照组外,对所有试验猪用prv e6株进行攻毒(10
6.0 tcid
50
/ml),每头滴鼻2.0ml。试验分组情况见下表8。
66.表8免疫持续期比较试验分组情况表注:“/”表示未进行此项。
67.按现行《中国兽药典》附录“3406 中和实验法”采用固定病毒稀释血清法对prv中和抗体效价进行测定,测试的免疫持续期比较结果见下表9。
68.表9免疫持续期比较试验结果注:“/”表示未进行此项。
69.从上表结果可以看出, 实验室制品201701批试验猪后35日、2个月、3个月、4个月、5个月和6个月中和抗体效价均高于1:16,而同类制品只有3/5或2/5高于1:16,而且滴度明显低于本实验室制品。
70.可见,免疫持续期试验中,免疫后35日、2个月、3个月、4个月、5个月和6个月分别采血分离血清,检测中和抗体效价,结果显示实验室制品中和抗体效价均优于同类制品。
71.综上,通过将实验室制备的猪伪狂犬病病毒基因缺失灭活疫苗(prv-e6
‑△
ge/gi株)与西班牙海博莱的猪伪狂犬病灭活疫苗(barthak61株)进行安全性、效力和免疫持续期比较,结果表明,本制品和同类产品均具有良好的安全性,但在面对prv变异强毒株时,却比同类产品具有更显著的免疫效力。
72.以上对本发明实施例进行了详细介绍,本文中应用了具体个例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的方法及其核心思想;同时,对于本领域的一般技术人员,依据本发明的思想,在具体实施方式及应用范围上均会有改变之处,综上所述,本说明书内容不应理解为对本发明的限制。
