1.本发明涉及多肽技术领域,具体涉及一种治疗高脂血症的贻贝降血脂寡肽。
背景技术:
2.高脂血症(hyperlipidemia,hlp),也称血脂异常或者脂蛋白异常血症,是由各种原因导致的血浆中的胆固醇(tc)、甘油三酯(tg)以及低密度脂蛋白胆固醇(ldl-c)水平升高和高密度脂蛋白胆固醇(hdl-c)过低的一种的全身脂质代谢。高脂血症(hlp)是动脉粥样硬化、胰腺炎、冠心病等疾病的危险因素。另外,高血脂症还可以导致糖尿病、脂肪肝、肝硬化、甲状腺功能减退、胰腺炎、高尿酸血症、肾病综合征等。降血脂药物通过调整血清中脂质含量、tc、tg、ldl-c和hdl-c等指标,改善机体脂质代谢。目前,由于毒副作用等因素,广泛使用的降血脂西药,如hmg-coa 还原酶抑制剂(他汀类药物),面临诸多问题。因此,研发新的高效、无毒副作用治疗高脂血症的药物尤为重要。
技术实现要素:
3.本发明以资源丰富的贻贝蛋白为原料,以降低油酸(oa)诱导的hepg2细胞脂质堆积模型中的脂质含量为指标,设计新的制备工艺,制备得到了降血脂功能显著且安全无毒性的降血脂肽,该降血脂肽可应用于治疗或者辅助治疗高脂血症。
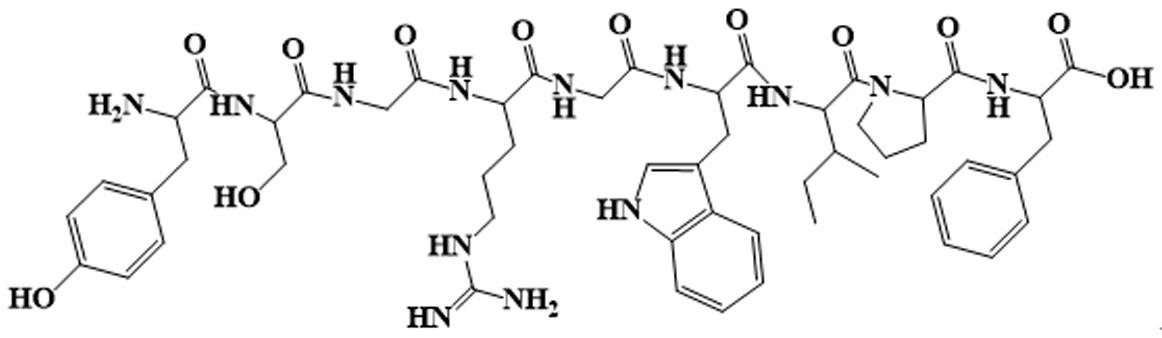
4.本发明提供了一种贻贝降血脂肽tyr-ser-gly-arg-gly-trp-ile-pro-phe(ysgrgwipf),esi-ms测定其分子量为1082.21 da。
5.一种贻贝降血脂肽tyr-ser-gly-arg-gly-trp-ile-pro-phe的制备,其包括以下步骤:1)原料预处理:紫贻贝(mytilus edulis)去壳和内脏、清洗、匀浆,加入乙酸乙酯,250 w超声脱脂25 min,过滤,重复3次上述操作,脱除脂质;干燥过滤所得固体物,研磨,得脱脂贻贝粉; 2)贻贝虾粉的酶解:取脱脂贻贝粉,加入缓冲液,调节ph值至7.0,加入贻贝粉重量2.5%中性蛋白酶,48℃酶解5小时,于沸水浴灭酶10 min,冷却至室温,后于12000 rmp离心15 min,收集上清液,得酶解液(mnh)。
6.3)贻贝寡肽的分离提取:将上述贻贝蛋白酶解液mnh利用截留分子量为3.0 kda的超滤膜分级,收集超滤组分mnh-i(分子量大于3.0 kda)和mnh-ii(分子量小于3.0 kda),测定超滤组分mnh-i和mnh-ii对油酸(oa)诱导的hepg2细胞脂质堆积模型中脂质降低能力(用%空白组表示)(见表1),选择降脂能力最强的超滤组分mnh-ii依次经凝胶色谱柱分离和反相高效液相色谱rp-hplc纯化。
7.作为优选,所述步骤1)中的匀浆后的紫贻贝与乙酸乙酯的重量体积比为比1g:9 ml。
8.作为优选,所述步骤2)中脱脂贻贝粉与缓冲液的重量体积比为1g:6 ml。
9.作为优选,所述步骤2)中缓冲液为ph为7的磷酸盐缓冲液。
10.作为优选,所述的步骤2)中的中性蛋白酶的酶活力≥2.0
×
10
5 u/g。
11.作为优选,所述步骤3)中的凝胶色谱柱分离步骤为:将mnh-ii溶于双蒸水配成浓度为40~50 mg/ml的溶液,经过0.45 μm微孔滤膜除去不溶物,加入到sephadex lh-20层析柱(2.5cm
×
160cm),用双蒸水进行洗脱,流速0.5-0.8 ml/min,根据214 nm色谱图收集色谱峰mnh-ii-1,mnh-ii-2和mnh-ii-3,测定各个色谱峰的降脂能力,活性最高色谱峰为凝胶层析酶解物。
12.作为优选,所述步骤3)中的反相高效液相色谱rp-hplc纯化步骤为:将mnh-ii-3用双蒸水配成25~30 μg/ml的溶液,经过0.45 μm微孔滤膜除去不溶物,加入到rp-hplc色谱柱进行纯化,根据214 nm色谱峰收集活性肽mnp-1~mnp-8,根据制备寡肽mnp-1~mnp-8的降血脂活性得1个高活性降脂肽mnp-2,氨基酸序列测定为tyr-ser-gly-arg-gly-trp-ile-pro-phe (ysgrgwipf),esi-ms测定分子量为1082.21 da。
13.进一步优选,所述rp-hplc条件为:进样量15 μl;色谱柱kromasil c-18(250 mm
×
4.6 mm,5 μm);流动相:在0-30 min内乙腈浓度从0匀速升至50%;紫外检测波长214 nm,洗脱速度0.8 ml/min。
14.本发明tyr-ser-gly-arg-gly-trp-ile-pro-phe(ysgrgwipf)能显著降低油酸诱导的hepg2细胞脂质堆积模型内脂质、胆固醇和甘油三酯含量,且能显著降低实验性高脂血症大鼠血清中的胆固醇、甘油三酯、低密度脂蛋白胆固醇含量,并能显著提高高密度脂蛋白胆固醇含量。可作为降血脂功能分子应用于治疗或者辅助治疗高脂血症的特医食品、保健品和药物。
15.本发明贻贝降血脂肽tyr-ser-gly-arg-gly-trp-ile-pro-phe(ysgrgwipf)可作为药物或者辅助药物用于降血脂相关疾病的治疗。
附图说明
16.图1是本发明实施例的超滤组分mnh-ii的sephadex lh-20层析图。
17.图2是本发明实施例sephadex lh-20制备酶解物mnh-ii-3的rp-hplc分析。
18.图3 为tyr-ser-gly-arg-gly-trp-ile-pro-phe (ysgrgwipf)的结构式。
19.图4 为tyr-ser-gly-arg-gly-trp-ile-pro-phe (ysgrgwipf)的质谱图。
20.图5为本发明实施例 tyr-ser-gly-arg-gly-trp-ile-pro-phe (ysgrgwipf)对油酸(oa)诱导的hepg2细胞脂质堆积模型中甘油三酯(tg)含量的影响。
21.其中,空白组:健康成年雄性 wistar 大鼠;模型组:高脂血症成年雄性 wistar大鼠;洛伐他汀:阳性对照组,用洛伐他汀治疗的高脂血症成年雄性 wistar大鼠;ysgrgwipf:为样品组,用ysgrgwipf治疗的高脂血症成年雄性 wistar大鼠。
22.图6为本发明实施例tyr-ser-gly-arg-gly-trp-ile-pro-phe (ysgrgwipf)对油酸(oa)诱导的hepg2细胞脂质堆积模型中胆固醇(tc)含量的影响。
23.其中,空白组:健康成年雄性 wistar 大鼠;模型组:高脂血症成年雄性 wistar大鼠;洛伐他汀:阳性对照组,用洛伐他汀治疗的高脂血症成年雄性 wistar大鼠;ysgrgwipf:为样品组,用ysgrgwipf治疗的高脂血症成年雄性 wistar大鼠。
24.图7为本发明实施例tyr-ser-gly-arg-gly-trp-ile-pro-phe (ysgrgwipf)对实验性高脂血症大鼠血清甘油三酯(tg)含量的影响。
25.其中,空白组:健康成年雄性 wistar 大鼠;模型组:高脂血症成年雄性 wistar大鼠;洛伐他汀:阳性对照组,用洛伐他汀治疗的高脂血症成年雄性 wistar大鼠;ysgrgwipf:为样品组,用ysgrgwipf治疗的高脂血症成年雄性 wistar大鼠。
26.图8为本发明实施例tyr-ser-gly-arg-gly-trp-ile-pro-phe (ysgrgwipf)对实验性高脂血症大鼠血清胆固醇(tc)含量的影响。
27.其中,空白组:健康成年雄性 wistar 大鼠;模型组:高脂血症成年雄性 wistar大鼠;洛伐他汀:阳性对照组,用洛伐他汀治疗的高脂血症成年雄性 wistar大鼠;ysgrgwipf:为样品组,用ysgrgwipf治疗的高脂血症成年雄性 wistar大鼠。
28.图9 为本发明实施例tyr-ser-gly-arg-gly-trp-ile-pro-phe (ysgrgwipf)对实验性高脂血症大鼠血清低密度脂蛋白胆固醇(ldl-c)含量的影响。
29.其中,空白组:健康成年雄性 wistar 大鼠;模型组:高脂血症成年雄性 wistar大鼠;洛伐他汀:阳性对照组,用洛伐他汀治疗的高脂血症成年雄性 wistar大鼠;ysgrgwipf:为样品组,用ysgrgwipf治疗的高脂血症成年雄性 wistar大鼠。
30.图10为本发明实施例 tyr-ser-gly-arg-gly-trp-ile-pro-phe (ysgrgwipf)对实验性高脂血症大鼠血清高密度脂蛋白胆固醇(hdl-c)含量的影响。
31.其中,空白组:健康成年雄性 wistar 大鼠;模型组:高脂血症成年雄性 wistar大鼠;洛伐他汀:阳性对照组,用洛伐他汀治疗的高脂血症成年雄性 wistar大鼠;ysgrgwipf:为样品组,用ysgrgwipf治疗的高脂血症成年雄性 wistar大鼠。
具体实施方式
32.下列实施例用于进一步解释说明本发明,但是,它们并不构成对本发明范围的限制或限定。
33.磷酸盐缓冲液(ph为7.0):取磷酸二氢钾0.68g,加入0.1mol/l氢氧化钠29.1ml,用水稀释至100ml。
实施例
34.1)原料预处理:紫贻贝(mytilus edulis)去壳和内脏、清洗、匀浆,按照料液比1g:9 ml加入乙酸乙酯,250 w超声脱脂25 min,过滤,重复3次上述操作,脱除脂质;干燥过滤所得固体物,研磨,得脱脂贻贝粉; 2)贻贝虾粉的酶解:取脱脂贻贝粉,按料液比1g:6 ml加入缓冲液,调节ph值至7.0,加入贻贝粉重量2.5%中性蛋白酶(酶活力2.0
×
10
5 u/g),48℃酶解5小时,于沸水浴灭酶10 min,冷却至室温,后于12000 rmp离心15 min,收集上清液,得酶解液(mnh);3)贻贝寡肽的分离提取:将上述贻贝蛋白酶解液mnh利用截留分子量为3.0 kda的超滤膜分级,收集超滤组分mnh-i(分子量大于3.0 kda)和mnh-ii(分子量小于3.0 kda),测定超滤组分mnh-i和mnh-ii对油酸(oa)诱导的hepg2细胞脂质堆积模型中脂质降低能力(用%空白组表示)(结果见表1),选择降脂能力最强的超滤组分mnh-ii依次经凝胶色谱分离和反相高效液相色谱纯化。
35.①
凝胶色谱分离:将mnh-ii溶于双蒸水配成浓度为40 mg/ml的溶液,经过0.45 μm微孔滤膜除去不溶物,加入到sephadex lh-20层析柱(2.5cm
×
160cm),用双蒸水进行洗脱,
流速0.6 ml/min,根据214 nm色谱图收集色谱峰mnh-ii-1,mnh-ii-2和mnh-ii-3(见图1),测定各个色谱峰的降脂能力(见表1),活性最高色谱峰为凝胶层析酶解物(mnh-ii-3)。
36.②
rp-hplc纯化:将mnh-ii-3用双蒸水配成28μg/ml的溶液,经过0.45 μm微孔滤膜除去不溶物,加入到rp-hplc色谱柱进行纯化(进样量15 μl;色谱柱kromasil c-18(250 mm
×
4.6 mm,5 μm);流动相:在0-30 min内乙腈浓度从0匀速升至50%;紫外检测波长214 nm),洗脱速度0.8 ml/min;根据214 nm色谱峰收集活性肽mnp-1~mnp-8(见图2),根据制备寡肽mnp-1~mnp-8的降血脂活性(见表2)得1个高活性降脂肽mnp-2,氨基酸序列测定为tyr-ser-gly-arg-gly-trp-ile-pro-phe (ysgrgwipf) (见图3),esi-ms测定分子量为1082.21 da(见图4)。
37.③
功能评价:采用油酸(oa)诱导的hepg2细胞脂质堆积模型和高脂血症大鼠体内实验评估贻贝降血脂寡肽ysgrgwipf治疗高脂血症的效果。
38.表1
ꢀꢀ
脂质含量(%空白组) 脂质含量(%空白组)空白组100mnh-ii117.5模型组136.1mnh-ii-1129.7阳性对照(洛伐他汀)103.9mnh-ii-2124.8mnh123.5mnh-ii-3116.2mnh-i130.5
ꢀꢀ
表2
ꢀꢀ
脂质含量(%空白组) 脂质含量(%空白组)空白组100mnp-4130.5模型组136.1mnp-5125.3阳性对照(洛伐他汀)103.9mnp-6122.9mnp-1115.7mnp-7120.8mnp-2109.3mnp-7125.4mnp-3128.4
ꢀꢀ
39.实验结果表明:ysgrgwipf能显著降低油酸(oa)诱导的hepg2细胞脂质堆积模型甘油三脂(tg)(见图5)和胆固醇(tc)的含量(见图6);同时,ysgrgwipf能显著降低实验性高脂血症大鼠血清tg(见图7)、tc(见图8)和ldl-c含量(见图9),升高hdl-c含量(见图10)。
40.综上,tyr-ser-gly-arg-gly-trp-ile-pro-phe (ysgrgwipf)显著降低细胞和动物模型中的血脂水平,且安全无毒副作用,可应用于治疗或者辅助治疗高脂血症的特医食品、保健品和药物。
41.最后,尚需注意的是,以上列举的仅是本发明的一个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
