1.本发明具体涉及一种锌离子近红外荧光探针及其制备方法和应用,本发明的锌离子近红外荧光探针是以咪唑为识别基团,属于细胞检测分析技术领域。
背景技术:
2.锌是人体必需的微量金属离子之一,广泛存在于细胞内,在人体细胞基因表达、新陈代谢、神经传递和机体免疫等活动中有重要的作用,同时在人体的智力发展、免疫发育等生命过程也发挥着重要的作用。锌浓度的过高或过低会引起某些疾病的发生,例如,锌离子的缺乏会导致身体发育迟缓、阿尔茨海默症等神经系统疾病;而过量的锌离子会抑制吞噬细胞的活性及其杀菌能力,从而降低人体的抗病能力,增加人体对疾病的易感性。因此,对细胞内锌的有效检测和监控对有关疾病的诊断和治疗具有重要意义。了解流动锌在生理和病理中的众多、复杂的作用,需要足够和灵敏的工具来检测它。
3.由于荧光探针高度的灵敏性及其选择性,在生物化学中得到了广泛的应用。可以用于快速检测各种金属离子的荧光传感器,因其响应时间快、可视度高、选择性强、灵敏度高、操作简单、廉价易得等诸多优点而受到广泛的关注。典型的荧光探针通常由三大部分组成,即作用基团、连接基团和荧光基团,作用基团实现探针和检测对象的选择性,连接基团则是将作用基团和荧光基团连接起来,而荧光基团主要是产生荧光信号。
4.申请号为cn201810093797.2的专利“一种锌离子探针及制备方法和应用”,具体公开了锌离子探针以非疾病或诊断目的作为检测锌离子的应用,同时公开了锌离子探针的一种制备方法;申请号为cn201810908578.5的专利“一种用于检测锌离子的探针”具体公开了上述锌离子探针的详细的制备方法。
技术实现要素:
5.本发明的目的在于提供一种锌离子近红外荧光探针及其制备方法和应用,通过对半花菁衍生物进行改造,合成了能够特异性对锌离子发生反应的近红外光的荧光分子探针,能够产生相应的光学效应,更好地识别出细胞内的锌离子。
6.本发明的技术方案如下:
7.本发明的目的在于提供一种锌离子近红外荧光探针,其化学结构式如下:
8.本发明的另一目的在于提供一种锌离子荧光探针的制备方法,包括如下步骤:
9.(1)将3-(氯甲基)-2-羟基-5-甲基苯甲醛与n-苄基-1-(1-甲基-1h-咪唑-2-基) 甲胺和碳酸钾在无水乙醇溶液中混合,常温条件下充分反应2~3h后加入1,2,3,3
ꢀ‑
四甲基-3h-吲哚碘化物,加热回流反应2~3h后,放置至常温;
10.(2)将混合液过滤后得到粗产物,粗产物经硅胶柱层析纯化得到产物锌离子近红外荧光探针。
11.其中,锌离子近红外荧光探针反应式如下:
[0012][0013]
进一步的,所述3-(氯甲基)-2-羟基-5-甲基苯甲醛,n-苄基-1-(1-甲基-1h-咪唑-2-基)甲胺和碳酸钾的摩尔比为1:2:(3~6)。
[0014]
进一步的,所述步骤(1)中加入的1,2,3,3-四甲基-3h-吲哚碘化物与n-苄基-1-(1-甲基-1h-咪唑-2-基)甲胺的摩尔比为2:1。
[0015]
本发明的另一目的在于提供一种锌离子近红外荧光探针在细胞中锌离子检测中的应用。
[0016]
相较于现有技术,本发明的有益效果在于:本发明提供的锌离子近红外荧光探针能够特异性与锌离子发生反应,并结合锌离子后产生显著的光学效应,本发明的荧光探针能够与锌离子发生反应,产生强烈的荧光,因此,利用本发明的探针能够较好地识别出锌离子,能够较好的检测细胞内的锌离子,进而对细胞活性和细胞毒性进行检测。
附图说明
[0017][0018]
图1为依旧本发明实施例2制备的荧光探针与不同浓度锌离子反应10分钟的光学性质分析图;
[0019]
图2为依旧本发明实施例2制备的荧光探针与不同浓度锌离子反应10分钟的荧光吸收对比图;
[0020]
图3为依旧本发明实施例2制备的不同浓度的荧光探针与43nm的锌离子反应10分钟的荧光吸收对比图;
[0021]
图4为依旧本发明实施例2制备的荧光探针的选择性变化的荧光吸收对比图;
[0022]
图5为依旧本发明实施例2制备的不同浓度的荧光探针对细胞毒性的分析示意图;
[0023]
图6为依旧本发明实施例2制备的荧光探针在raw264.7细胞中的荧光吸收示意图。
[0024]
图7为依旧本发明实施例2制备的荧光探针在raw264.7细胞中的荧光强度示意图。
具体实施方式
[0025]
下面结合附图和较佳实施例对本发明做进一步的说明,给出的实施例仅为了阐明
本发明,而不是为了限制本发明的范围。
[0026]
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到且所有商用试剂均为进行进一步纯化;
[0027]
反应中所使用的干燥溶剂均使用分子筛4a型(钠-a型分子筛)或分子筛 3a型(钾-a型分子筛)进行干燥;
[0028]
惰性气氛均使用氩气作为保护气体;
[0029]1h谱在jeol ecz600s(600mhz)光谱仪上记录,使用cdcl3或cd3od作为溶剂;
[0030]
根据内部tms(三甲基硅烷)参考数据,报告了前场化学位移的百万分之一;
[0031]
耦合常数(j)以赫兹(hz)表示,自旋重态用s(单线态)、d(双线态)、t(三重态) 和m(多重态)表示;
[0032]
柱层析采用厚壁玻璃柱和硅胶(300-400目);采用市售0.25mm硅胶板进行薄层色谱(tlc),紫外灯显示;
[0033]
使用岛津uv-1900紫外-可见-近红外分光光度计获得溶液中的紫外吸收光谱;荧光光谱采用spectrofluorometer fs5荧光光谱仪测定;质谱在thermofisher 高效液相色谱-质谱联用仪上记录;
[0034]
利用zeiss激光共聚焦显微镜进行细胞荧光成像。
[0035]
实施例1
[0036]
一种以咪唑为识别基团的新型锌离子近红外荧光探针,其化学结构式如下:
[0037][0038]
实施例2
[0039]
上述以咪唑为识别基团的锌离子近红外荧光探针的制备方法,包括如下步骤:
[0040]
(1)将2mmol 3-(氯甲基)-2-羟基-5-甲基苯甲醛与4mmol n-苄基-1-(1
‑ꢀ
甲基-1h-咪唑-2-基)甲胺和6mmol碳酸钾在无水乙醇溶液中,常温条件下充分反应2h后,加入2mmol 1,2,3,3-四甲基-3h-吲哚碘化物,加热回流反应2h后,放置至常温;
[0041]
(2)将混合液过滤后得到粗产物,粗产物经硅胶柱层析纯化得到产物荧光探针s2;
[0042]
实施例3
[0043]
上述以咪唑为识别基团的锌离子近红外荧光探针的制备方法,包括如下步骤:
[0044]
(1)将1mmol 3-(氯甲基)-2-羟基-5-甲基苯甲醛与2mmol n-苄基-1-(1
‑ꢀ
甲基-1h-咪唑-2-基)甲胺和6mmol碳酸钾在无水乙醇溶液中,常温条件下充分反应2.5h后,加入1mmol 1,2,3,3-四甲基-3h-吲哚碘化物,加热回流反应2.5h 后,放置至常温;
[0045]
(2)将混合液过滤后得到粗产物,粗产物经硅胶柱层析纯化得到产物荧光探针s2;
[0046]
实施例4
[0047]
一种锌离子荧光探针的制备方法,包括如下步骤:
[0048]
(1)将3mmol 3-(氯甲基)-2-羟基-5-甲基苯甲醛与6mmol n-苄基-1-(1
‑ꢀ
甲基-1h-咪唑-2-基)甲胺和9mmol碳酸钾在无水乙醇溶液中,常温条件下充分反应3h后,加入3mmol 1,2,3,3-四甲基-3h-吲哚碘化物,加热回流反应3h后,放置至常温;
[0049]
(2)将混合液过滤后得到粗产物,粗产物经硅胶柱层析纯化得到产物荧光探针s2;
[0050]
实施例5依据实施例2制得的荧光探针的光谱测定
[0051]
将依据实施例2制得的荧光探针溶于dmso中,配置10mm的工作母液备用,向3.5ml比色皿中加入3ml hepes缓冲液,将3ul荧光探针(10mm) 与3ul 10%pluronic混匀,加入比色皿中,分别测定荧光探针的紫外光谱和荧光光谱;再向比色皿中加入不同浓度的锌离子、生物体内常见的离子(na
+
、k
+
、 ca
2+
、mg
2+
、fe
2+
、fe
3+
、al
3+
、ni
2+
、br-、i-、hco
3-、co
32-、i-、clo-、br-、 h2o2),测定荧光探针与这些物质反应后的紫外光谱特性以及荧光光谱特性;实验中使用的荧光激发和发射的狭缝均为4nm,扫描2次。
[0052]
参见图1,图1为s2与浓度为0-43nm锌离子反应10min的紫外吸收的变化图,由图可知,随着加入的锌离子浓度的升高,探针在506nm处的紫外吸收逐渐增强,结果证明,s2能够与锌离子发生反应;
[0053]
参见图2,图2为s2与浓度为0-43nm锌离子反应10min的荧光吸收的变化图,由图可知,随着加入的锌离子浓度的升高,荧光探针在634nm处的荧光吸收逐渐增强;结果证明,荧光探针能够与锌离子结合,并使其荧光吸收增加;
[0054]
参见图3,图3为本发明制得的荧光探针(10-50μm)与浓度为43nm的锌离子反应10min内的荧光吸收的变化图,由图可知,随着荧光探针加入的浓度增加,634nm处的荧光吸收升高;
[0055]
参见图4,图4为本发明制得的荧光探针的选择性变化的荧光吸收的对比图 (金属离子10mm和阴离子2mm),由图可知,荧光探针在分别加入含有不同离子hepes缓冲液后,对锌离子荧光探针表现出有良好的选择性;
[0056]
综上所述,根据相应的化学效应及光学效应,本发明制得的荧光分子探针 s2具有检测锌离子的能力。
[0057]
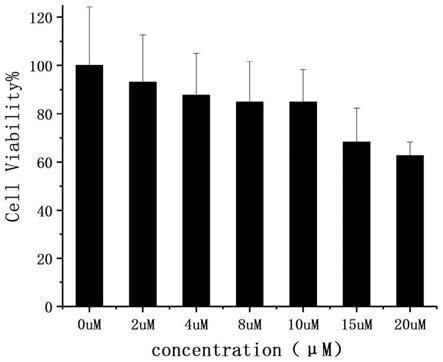
实施例6依据实施例2制得的荧光探针s2的cck-8毒性测试
[0058]
将贴壁的raw264.7细胞用培养基把细胞轻轻吹下,低速离心(900 rpm/min,25℃,5min),除去旧培养基,加入新培养基,吹匀制成细胞悬液后把细胞铺至96孔板中;实验共分成三组,空白组、对照组和实验组;其中,空白组中有培养基、有cck-8溶液、无细胞、无探针;对照组中有细胞、有cck-8 溶液、无探针;实验组有细胞、有cck-8溶液、有探针;每孔铺板的细胞量为 5
×
103个,每孔加入培养基200μl,培养24h待细胞贴壁稳固后,向每孔中加入不同浓度的荧光探针s2(2μm、4μm、8μm、10μm、15μm和20μm);孵育20min,加入20μl cck-8试剂,置于37℃反应3h后在振荡器上轻轻混匀,放入酶标仪后测定450nm波长吸光度,每一个条件均设置4个重复对照;
[0059]
细胞存活率计算:细胞存活率(%)=[a(实验组)-a(空白组)]/[a(对照组)
‑ꢀ
a(空白组)]
×
100%。
[0060]
参见图5为不同浓度的荧光探针s2对细胞的毒性大小分析,由图可知,细胞在加入不同浓度的荧光探针s2刺激24h后,细胞的存活率呈现出显著的差异性,0-4μm的荧光探针
s2对细胞基本不显示毒性,超过8μm后,对细胞产生微弱的毒性。
[0061]
实施例7依据实施例1制得的荧光探针s2的细胞成像
[0062]
将raw264.7细胞铺板至激光共聚焦皿中(7
×
103个细胞),培养14h后,除去培养基,hbss清洗两遍,除去残余培养基,向激光共聚焦皿中加入10μm 荧光探针s2,避光染色20min;染色结束后,用hbss清洗,除去残留染液,加入hbss后进行成像采集。拍照后向皿中加入20μm的吡啶硫酮锌后进行的图像采集,最后加入50μm tpen进行图像采集;
[0063]
参见图6,图6为s2在正常raw264.7细胞中的活细胞成像照片,由图可知,荧光探针s2加入后,细胞呈现微弱的红色荧光,向皿中加入20μm的吡啶硫酮锌后,荧光增强,加入50μm tpen后,细胞荧光猝灭;结果证明,荧光探针 s2能够检测到活细胞中的锌离子;
[0064]
参见图7,图7为s2在正常raw264.7细胞中的活细胞成像荧光强度折线图,由图可知,荧光探针s2加入后,细胞的荧光强度在653左右,加入20μm的吡啶硫酮锌后,荧光强度达到848左右,反应10min荧光强度达到905左右,维持相对稳定,加入tpen后,荧光强度锐减至144;结果证明,荧光探针s2是能够较好的在活细胞中检测锌离子。
[0065]
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
