1.本发明涉及基因工程技术领域,具体而言,涉及一种获取驱动元件的方法。
背景技术:
2.随着医疗手段的不断演进和基因技术的突飞猛进的发展,医学工作者发现,经基因改造的细胞可以对其他细胞,如癌细胞的特定状态作出高特异性的检测,如基于hela细胞中特有的mi crorna表达模式所建立的能够区分人宫颈癌细胞hela与人正常健康细胞hek293的人工合成基因电路。这些人工合成基因电路可以在甄别癌细胞以及靶向杀灭癌细胞方面发挥优异的性能。
3.但是,现有的基因电路所使用的驱动元件往往仅通过较为单一固定的mi crorna及自然启动子的表达模式来组成,而这套表达模式仅能区分癌细胞与正常健康细胞,不能区分在癌细胞总群体中因癌细胞之间的异质性而出现的各类癌细胞亚群,而癌细胞之间的异质性恰恰就是癌细胞耐药复发的最关键因素,少部分顽固的异质性癌细胞亚群可通过高转移能力进入血液循环系统,容易造成日后病患的全身性复发。因此,亟待提供一种获取驱动元件的方法,从而获取具备更好的区分甄别性能的驱动元件。
技术实现要素:
4.本发明的目的是提供一种获取驱动元件的方法,以至少部分地解决上述的技术问题。
5.本发明提供一种获取驱动元件的方法,包括下列步骤:
6.步骤1:基于癌细胞系的癌细胞,在化疗药物和靶向药物联用培养的条件下,制备得到至少两个耐药癌细胞亚群;
7.步骤2:基于每个步骤1的所述耐药癌细胞亚群,制备得到至少一个预选启动子,每个所述预选启动子包括至少一个正向启动子和至少一个负向启动子;
8.步骤3:在慢病毒载体上插入所述预选启动子构建启动子测试慢病毒;
9.步骤4:构建分别对应于步骤1至少两个所述耐药癌细胞亚群的至少两种细胞表型状态评估器,每个所述细胞表型状态评估器的基因序列在评估启动子和特异性状靶向因子之间分别插入有不同的荧光蛋白;
10.步骤5:选取所述癌细胞系的所述癌细胞,在慢病毒载体上插入所述细胞表型状态评估器构建评估器慢病毒,使用所述评估器慢病毒感染所述癌细胞,获得稳转癌细胞系;
11.步骤6:使用步骤3的所述启动子测试慢病毒感染步骤5的所述稳转癌细胞系,获得双重稳转癌细胞系;
12.步骤7:在所述化疗药物和所述靶向药物联用培养的条件下培养所述双重稳转癌细胞系,基于双重稳转癌细胞系的存活率,在步骤2的所述预选启动子中,筛选得到基因电路中的驱动元件。
13.优选地,步骤1中,所述癌细胞系为人肝癌高转移细胞系mhcc997h。
14.优选地,步骤4中,所述细胞表型状态评估器包括慢细胞周期型细胞表型状态评估器、细胞骨架重组型细胞表型状态评估器和抗凋亡型细胞表型状态评估器中的至少之一;
15.所述慢细胞周期型细胞表型状态评估器所包含的所述特异性状靶向因子用于识别是否存在慢细胞周期型癌细胞,所述细胞骨架重组型细胞表型状态评估器所包含的所述特异性状靶向因子用于识别是否存在细胞骨架重组型癌细胞,所述抗凋亡型细胞表型状态评估器所包含的所述特异性状靶向因子用于识别是否存在抗凋亡型癌细胞。
16.优选地,所述慢细胞周期型细胞表型状态评估器所包含的所述特异性状靶向因子的序列均包括如seq id no.1-seq id no.4任一项所示的正向序列和如seq id no.5所示的负向序列。
17.优选地,所述细胞骨架重组型细胞表型状态评估器所包含的所述特异性状靶向因子的序列均包括如seq id no.6-seq id no.9任一项所示的正向序列和如seq id no.10所示的负向序列。
18.优选地,所述抗凋亡型细胞表型状态评估器所包含的所述特异性状靶向因子的序列包括如seq id no.11-seq id no.14任一项所示的正向序列和如seq id no.15所示的负向序列。
19.优选地,所述细胞骨架重组型细胞表型状态评估器和所述抗凋亡型细胞表型状态评估器的载体至少包括依次连接的barcode region、所述评估启动子、所述荧光蛋白、所述特异性状靶向因子、3'utr端、cmv启动子、反式作用因子、所述特异性状靶向因子和3'utr端,所述荧光蛋白至少选自eyfp、ebfp2和irfp中的任意一种。
20.优选地,所述评估启动子至少包括tre3g启动子,所述反式作用因子至少包括rtta3反式作用因子。
21.优选地,所述载体在所述反式作用因子、所述特异性状靶向因子和所述3'utr端之后,还依次连接有ef1启动子、blastr和wpre。
22.优选地,所述启动子测试慢病毒至少包括依次连接的所述预选启动子、mscarlet、wpre、ef1启动子、puror和wpre。
23.本发明通过对癌细胞进行耐药培养,从而获得多个不同的预选启动子,利用预选启动子构建启动子测试慢病毒,并结合不同的细胞表型状态评估器,从而基于癌细胞分别利用细胞表型状态评估器和启动子测试慢病毒进行感染获得双重稳转癌细胞系,并基于该双重稳转癌细胞系的耐药培养结果,判断何种预选启动子能够较高地识别多种亚型的癌细胞系,从而可以将该种预选启动子作为后续所构建的基因电路中的驱动元件。
附图说明
24.通过阅读参照以下附图所作的对非限制性实施例的详细描述,本发明的其它特征、目的和优点将会变得更明显:
25.图1是根据本发明的获取驱动元件的方法的示意图;
26.图2是根据本发明的启动子测试慢病毒中所包含的基因序列的示意图;
27.图3是根据本发明的细胞表型状态评估器中所包含的基因序列的示意图。
具体实施方式
28.下面结合附图和实施例对本发明作进一步的详细说明。可以理解的是,此处所描述的具体实施例仅用于解释相关发明,而非对该发明的限定。为了便于描述,附图中仅示出了与发明相关的部分。
29.需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。
30.本技术实施例提供一种获取驱动元件的方法,需要说明的是,该基因电路可以应用于癌细胞的多种亚型的识别,如smmc-7721或mhcc997h癌细胞系在耐药条件下所产生的多个亚型的识别,也可以与靶向药物相结合,制备得到能够精准杀灭某种亚型的癌细胞的靶向药物等,其具体用途本技术并不作限制。对应的,本技术实施例中所述的驱动元件,即由启动子或包含启动子的元件所构成的,具备识别功能的一段基因片段,因其在基因电路中负责识别特定的目标基因片段并启动后续的识别显示或治疗过程,因此称其为驱动元件,本技术实施例并不将驱动元件仅限为启动子,也可以是包含启动子和其他基因片段的组合。
31.本技术实施例中的癌细胞系,主要是指基因表达类似的一组癌细胞的总称,例如smmc-7721或mhcc997h系,本技术实施例中的癌细胞可为肝癌、胶质母细胞瘤、胆道癌、肺癌、胰腺癌、黑素瘤、骨癌、乳腺癌、结直肠癌、胃癌、前列腺癌、白血病、子宫癌、卵巢癌、淋巴瘤或脑癌,更优选为肝癌、胶质母细胞瘤或胆道癌,最优选为肝癌。
32.本技术中的耐药癌细胞亚群,主要是指经过化疗药物和靶向药物联用培养之后能够存活的癌细胞所组成的群落,其基因表达与所属的癌细胞系有一定区别,因此称其为亚群。这样的耐药癌细胞亚群往往是在癌症治疗过程中反复复发的元凶,其具备耐药性,同时还有可能具备高转移性等其它恶性性状,也是本发明所针对的主要目标。
33.在本技术实施例中,构建启动子测试慢病毒所使用的病毒载体可为来源于逆转录病毒,例如,人免疫缺陷病毒(human immunodeficiency virus,hiv)、小鼠白血病病毒(murine leukemia virus,mlv)、禽肉瘤/白血病病毒(avian sarcoma/leucosis virus,aslv)、脾脏坏死病毒(spleennecrosis virus,snv)、劳氏肉瘤病毒(rous sarcoma virus,rsv)、小鼠乳腺肿瘤病毒(mouse mammary tumor virus,mmtv)等)、腺病毒(adenovirus)、腺相关病毒(adeno-associated virus,aav)、或单纯疱疹病毒(herpes simplex virus,hsv)等,但不限于此。基于逆转录病毒构建启动子测试慢病毒的技术为本领域技术人员所熟知,此处不再赘述。
34.本技术实施例中,除了如启动子、操纵子、起始密码子、终止密码子、聚腺苷酸化信号和增强子的表达调控元件以外,本发明的载体还包括用于膜靶向或分泌的信号序列或前导序列,并可以根据目的以各种方式进行制备。载体的启动子可为组成型或诱导型。此外,表达载体包含用于选择含有载体的宿主细胞的选择标记,并且当表达载体为可复制的表达载体时,可包括复制子。载体可自我复制或整合到宿主dna中。
35.在本技术实施例中,所使用的术语“插入”和“连接”是指,执行常规功能的核酸表达调控序列与编码目的基因的核酸序列的功能性连接(functional linkage)。例如,当在逆转录病毒的基因序列中插入启动子时,逆转录病毒的基因序列的表达可处于启动子的影响或调控之下。当启动子的基因序列与逆转录病毒的基因序列之间的连接特性不诱导移码
突变,且在表达调控序列不抑制核酶的表达时,则可以认为完成了本技术实施例中的“插入”或“连接”。可使用本领域公知的基因重组技术来实现该“插入”或“连接”过程,并且可以采用本领域公知的酶来进行位点特异性dna的切割和连接。
36.本技术实施例中的荧光蛋白,可以选自萤光素酶(luciferase)、绿色荧光蛋白(gfp)、修饰型绿色荧光蛋白(modified green fluorescent protein,mgfp)、增强型绿色荧光蛋白(enhanced green fluorescentprotein,egfp)、红色荧光蛋白(rfp)、修饰型红色荧光蛋白(modified red fluorescent protein,mrfp)、增强型红色荧光蛋白(erfp)、蓝色荧光蛋白(bfp)、增强型蓝色荧光蛋白(ebfp)、黄色荧光蛋白(yfp)、增型黄色荧光蛋白(eyfp)、青色荧光蛋白(cfp)或增强型青色荧光蛋白(ecfp)等,但不限于此。通过将荧光蛋白插入于目的基因中,可以观察到癌细胞特异性核酶的表达水平。对于本领域技术人员来说,可以理解的是,可用这种方法来判断是否存在特定种类的癌细胞。
37.本技术实施例中的特异性状靶向因子,如seq id no.16-seq id no.30任一项所示的序列:
38.seq id no.16:ggaaagctagaaggttgtacag;
39.seq id no.17:cacaaattcggatctacagggta;
40.seq id no.18:gaaacccagcagacaatgtagct;
41.seq id no.19:tcatacagctagataaccaaaga;
42.seq id no.20:ccaaacactgctgggtaagacg;
43.seq id no.21:tgagcggtgagggcatacag;
44.seq id no.22:tcacataggaatgaaaagccata;
45.seq id no.23:taaccgatttcagatggtgcta;
46.seq id no.24:acaaccagctaagacactgcca;
47.seq id no.25:taaccgatttcagatggtgcta;
48.seq id no.26:atccagaagtggctaataatat;
49.seq id no.27:tcaacatcagtctgataagcta;
50.seq id no.28:acagcccatcgactggtgttg;
51.seq id no.29:atgccctttcatcattgcactg;
52.seq id no.30:cacaagatcggatctacgggtt。
53.本技术实施例中的细胞表型状态评估器,是指结合有特定的特异性状靶向因子,并组合有评估启动子和荧光蛋白,能够通过感染-表达-显色过程识别是否存在特定时期的癌细胞,如干细胞样/慢细胞周期型细胞、/细胞骨架重组型细胞或抗凋亡型细胞的一个功能性的载体,其应用可以准确地判断预选启动子所能够识别的细胞类型。本技术实施例中结合在细胞表型状态评估器中的评估启动子,如seq id no.31-seq id no.40任一项所示的序列:
54.seq id no.31:tttgcataacaaaggagatttgcataacaaaggtcgtttgcataacaaagggactttgcataacaaaggctatttgcataacaaaggacttttgcataacaaaggtgctttgcataacaaagggta;
55.seq id no.32:cctttgttatgcaaatagacctttgttatgcaaattcgcctttgttatgcaaatgaccctttgttatgcaaatctacctttgttatgcaaatactcctttgttatgcaaattgc;
56.seq id no.33:aaaagctttctaggaaagaaaaagctttctaggaatcgaaaagctttctaggaag
acaaaagctttctaggaactaaaaagctttctaggaaactaaaagctttctaggaatgc;
57.seq id no.34:gcgtaaataagagcgtaaatatcggcgtaaatagacgcgtaaatactagcgtaaataactgcgtaaatatgcgcgtaaatagtagcgtaaata;
58.seq id no.35:acccaggtggagaacccaggtggtcgacccaggtgggacacccaggtggctaacccaggtggactacccaggtggtgcacccaggtgggtaacccaggtgg;
59.seq id no.36:aacaggtgtagaaacaggtgttcgaacaggtgtgacaacaggtgtctaaacaggtgtactaacaggtgttgcaacaggtgtgtaaacaggtgt;
60.seq id no.37:acacaggtaagtaagaacacaggtaagtatcgacacaggtaagtagacacacaggtaagtactaacacaggtaagtaactacacaggtaagtatgcacacaggtaagtagtaacacaggtaagta;
61.seq id no.38:gccggaagtgagagccggaagtgtcggccggaagtggacgccggaagtgctagccggaagtgactgccggaagtgtgcgccggaagtggtagccggaagtg;
62.seq id no.39:cacttccgggaaatgagacacttccgggaaatgtcgcacttccgggaaatggaccacttccgggaaatgctacacttccgggaaatgactcacttccgggaaatgtgccacttccgggaaatggta;
63.seq id no.40:ccttggaaatcccctagaccttggaaatccccttcgccttggaaatcccctgacccttggaaatcccctctaccttggaaatcccctactccttggaaatccccttgcccttggaaatcccctgta。
64.本技术实施例中的稳转癌细胞系,是指经过细胞表型状态评估器感染所得到的,基因序列中已经被插入荧光蛋白的癌细胞。本技术实施例中的双重稳转癌细胞系,是指被启动子测试慢病毒所感染的稳转癌细胞系得到的具备待选启动子的癌细胞系,其能够在耐药性培养中根据待选启动子的性质不同表现出不同的性状,从而结合荧光蛋白的荧光反应,显示出对应的待选启动子的性质。
65.本技术实施例所提供的获取驱动元件的方法,如图1所示,包括下列步骤:
66.步骤1:基于癌细胞系的癌细胞,在化疗药物和靶向药物联用培养的条件下,制备得到至少两个耐药癌细胞亚群;
67.步骤2:基于每个步骤1的耐药癌细胞亚群,制备得到至少一个预选启动子,每个预选启动子包括至少一个正向启动子和至少一个负向启动子;
68.步骤3:在慢病毒载体上插入预选启动子构建启动子测试慢病毒;
69.步骤4:构建分别对应于步骤1至少两个耐药癌细胞亚群的至少两种细胞表型状态评估器,每个细胞表型状态评估器的基因序列在评估启动子和特异性状靶向因子之间分别插入有不同的荧光蛋白;
70.步骤5:选取癌细胞系的癌细胞,在慢病毒载体上插入细胞表型状态评估器构建评估器慢病毒,使用评估器慢病毒感染癌细胞,获得稳转癌细胞系;
71.步骤6:使用步骤3的启动子测试慢病毒感染步骤5的稳转癌细胞系,获得双重稳转癌细胞系;
72.步骤7:在化疗药物和靶向药物联用培养的条件下培养双重稳转癌细胞系,基于双重稳转癌细胞系的存活率,在步骤2的预选启动子中,筛选得到基因电路中的驱动元件。
73.在步骤1中,可以是在同一种化疗药物和靶向药物的配比下联用培养,并控制不同的培养时间,得到不同的耐药癌细胞亚群,也可以改变化疗药物和靶向药物的配比并联用培养相同的时间,从而得到不同的耐药癌细胞亚群,也可以是其它能够得到不同的耐药癌细胞亚群的方法,这一步主要是为了模拟实际服药并产生不同耐药癌细胞亚群的环境,并
为下一步制备得到不同的预选启动子做准备。
74.步骤2中基于不同的耐药癌细胞亚群制备得到不同的预选启动子的方式,如离心、分离、扩增等均为本领域技术人员所熟知的技术手段,此处不再赘述。步骤2中的正向启动子主要是指有正向活性指示反应的启动子,即癌细胞活性从无到有,负向启动子主要是指有负向活性指示反应的启动子,即癌细胞活性从有到无。这样可以提高在一次获取驱动元件的过程中即可获得满足要求的驱动元件的概率。
75.步骤3及步骤4中的制备过程,如在特定位点敲除、插入并功能性连接的手段,如crispr技术、crispr-cas9技术等,均为领域技术人员所熟知,此处不再赘述。
76.步骤5中,当所选择癌细胞系为登记序号为mhcc997h的人高转移性肝癌细胞系时,其具体实现方式可以是将不同的细胞表型状态评估器通过慢病毒载体形式均匀混合后感染待研究对象细胞,使用blasticidin筛选出稳转肝癌细胞系。当然,当所使用的癌细胞系为其他癌细胞系时,对应的筛选方式应当做出对应调整,此处不再赘述。
77.在步骤6中,用构建好的合成启动子慢病毒测试载体感染含有细胞表型状态评估器的稳转癌细胞系之后,优选地,当所选择癌细胞系为人高转移性肝癌细胞系mhcc997h时,可以使用puromycin筛选出合成启动子慢病毒测试载体与细胞表型状态评估器双重稳转癌细胞系。
78.在步骤7中,对上述双重稳转肝癌细胞系添加肿瘤药物,可以与在步骤1中进行耐药培养的药物相同,也可以是某种待测试的抗癌药物,经过数天后,可以是通过流式细胞术分析每种启动子的荧光报告基因mscarlet在不同的荧光蛋白表达细胞中的表达比例;也可通过流式细胞分选技术提取启动子mscarlet荧光与其它荧光重叠的细胞,扩增优化评估器上的barcode region(条形码区域),得出该启动子可以标识出何种状态mirna所能代表的耐药细胞亚群。选择能够最大限度覆盖eyfp、ebfp2、irfp表达细胞的一套合成启动子,进行后续功能性基因电路构建实验。
79.作为一种优选的实施方式,癌细胞系为登记序号为mhcc997h的人高转移性肝癌细胞系。
80.作为一种优选的实施方式,化疗药物为doxorubicin,靶向药物为sorafenib。
81.作为一种优选的实施方式,如图2所示,细胞表型状态评估器包括慢细胞周期型细胞表型状态评估器、细胞骨架重组型细胞表型状态评估器和抗凋亡型细胞表型状态评估器至少之一;
82.慢细胞周期型细胞表型状态评估器所包含的特异性状靶向因子用于识别是否存在慢细胞周期型癌细胞,细胞骨架重组型细胞表型状态评估器所包含的特异性状靶向因子用于识别是否存在细胞骨架重组型癌细胞,抗凋亡型细胞表型状态评估器所包含的特异性状靶向因子用于识别是否存在抗凋亡型癌细胞。
83.作为一种优选的实现方式,慢细胞周期型细胞表型状态评估器所包含的特异性状靶向因子的序列包括如seq id no.1-seq id no.4任一项所示的正向序列和如seq id no.5所示的负向序列:
84.seq id no.1:ggaaagctagaaggttgtacag;
85.seq id no.2:cacaaattcggatctacagggta;
86.seq id no.3:gaaacccagcagacaatgtagct;
87.seq id no.4:tcatacagctagataaccaaaga;
88.seq id no.5:ccaaacactgctgggtaagacg。
89.作为一种优选的实现方式,/细胞骨架重组型细胞表型状态评估器所包含的特异性状靶向因子的序列均包括如seq id no.6-seq id no.9任一项所示的正向序列和如seq id no.10所示的负向序列:
90.seq id no.6:tgagcggtgagggcatacag;
91.seq id no.7:tcacataggaatgaaaagccata;
92.seq id no.8:taaccgatttcagatggtgcta;
93.seq id no.9:acaaccagctaagacactgcca;
94.seq id no.10:taaccgatttcagatggtgcta。
95.作为一种优选的实现方式,抗凋亡型细胞表型状态评估器所包含的特异性状靶向因子的序列均包括如seq id no.11-seq id no.14任一项所示的正向序列和如seq id no.15所示的负向序列:
96.seq id no.11:atccagaagtggctaataatat;
97.seq id no.12:tcaacatcagtctgataagcta;
98.seq id no.13:acagcccatcgactggtgttg;
99.seq id no.14:atgccctttcatcattgcactg;
100.seq id no.15:cacaagatcggatctacgggtt。
101.作为一种优选的实施方式,慢细胞周期型细胞表型状态评估器、细胞骨架重组型细胞表型状态评估器和抗凋亡型细胞表型状态评估器的载体至少包括依次连接的barcode region、评估启动子、荧光蛋白、特异性状靶向因子、3'utr端、cmv启动子、反式作用因子、特异性状靶向因子和3'utr端,荧光蛋白至少选自eyfp、ebfp2和irfp中的任意一种。
102.作为一种优选的实施方式,评估启动子至少包括tre3g启动子,反式作用因子至少包括rtta3反式作用因子。
103.作为一种优选的实施方式,在载体在反式作用因子、特异性状靶向因子和3'utr端之后,还依次连接有ef1启动子、blastr和wpre。
104.作为一种优选的实施方式,启动子测试慢病毒至少包括依次连接的预选启动子、mscarlet、wpre、ef1启动子、puror和wpre。
105.本发明通过对癌细胞进行耐药培养,从而获得多个不同的预选启动子,利用预选启动子构建启动子测试慢病毒,并结合不同的细胞表型状态评估器,从而基于癌细胞分别利用细胞表型状态评估器和启动子测试慢病毒进行感染获得双重稳转癌细胞系,并基于该双重稳转癌细胞系的耐药培养结果,判断何种预选启动子能够较高地识别多种亚型的癌细胞系,从而可以将该种预选启动子作为后续所构建的基因电路中的驱动元件。
106.以下,将参考实施例详细描述本发明。然而,根据本说明书的实施例可修改为各种其他形式,并且本说明书的范围不应解释为限于以下描述的实施例。提供本说明书的实施例的目的在于向本领域技术人员更充分地描述本说明书。
107.实施例
108.材料
109.细胞:
110.mhcc97h人高转移性肝癌细胞系,由中科院上海细胞生物研究所究所提供。
111.药品及试剂:
112.doxorubicin(阿霉素),规格:10mg,批号:kfs276,供应商:百奥莱博。
113.sorafenib(索拉非尼)规格:10mg,批号:bay 43-9006,供应商:上海芮晖化工科技有限公司。
114.洛斯维-1640(rpmi-1640)培养基及胎牛血清(fbs),购自美国gibco公司。
115.doxycycline(盐酸强力霉素),规格:10mm/ml,批号:id0390-10mm*1ml(in water),供应商:索莱宝。
116.质粒合成自通用生物(安徽),分类器质粒骨架均使用swb-blasticidin慢病毒骨架,合成启动子载体骨架使用swp-puromycin。
117.lipofectamine 3000,规格:1ml,批号:l3000015,供应商:thermalfisher。
118.慢病毒包装试剂盒,规格:100ml,批号:gm-040801-100,供应商:吉满生物。
119.仪器:
120.cx41倒置相差显微镜和bx51荧光显微镜,均购自日本olympus公司;dtx880酶联免疫检测仪,购自美国beckman公司;751gd紫外分光光度计,购自杭州汇尔仪器有限公司;cytoflex流式细胞仪,购自贝克曼库尔特国际贸易(上海)有限公司。
121.实施方法:
122.mhcc97h肝癌细胞用含10%fbs,0.1μm doxorubicin及5μm sora fenib的rpmi-1640培养基于37℃,5%co2培养箱中培养。3天传代1次,取对数生长期的细胞进行耐药合成启动子高通量功能筛选得到的多个耐药癌细胞亚群体。
123.从得到的耐药癌细胞亚群体中筛选有正向(活性从无到有)或负向(活性从有到无)活性指示反应的待选启动子,将筛选得到的待选启动子依次标记为样本1至样本10组装进包含如图2所示的基因序列的启动子测试慢病毒。
124.慢病毒包装成功后,收集慢病毒上清液,0.45μm滤器过滤,去除细胞和碎片。
125.按4:1的体积比例混合慢病毒上清液(4份)和5x慢病毒浓缩液(1份),4℃放置2小时或者过夜,刚开始时每隔30min混匀一下,混匀进行3次。
126.在4℃以4000g离心25min。
127.小心移除上清,加入适量体积(原上清液体积的1/100~1/10)的dmem或者pbs,使用移液器小心吹打,重悬沉淀物。
128.重悬后的病毒以50μl管分装,80℃冰箱保存。
129.按图3所示结构构建慢细胞周期型细胞、细胞骨架重组型细胞或抗凋亡型细胞三类大类细胞表型状态评估器,每大类细胞表型状态评估器各带eyfp、ebfp2和irfp三种不同的荧光表达功能,每大类细胞表型状态评估器中,包括含有指示相同表型状态特征的,但带有不同mirna靶向识别位点的4种不同细胞表型状态评估器。
130.其中,每种大类分类器的上述4种正向特异靶向序列依次同1种负向特异靶向序列组合成4种同细胞表型状态评估器,例如,正向:seq id no.1-负向:seq id no.5、正向:seq id no.2-负向:seq id no.5、正向:seq id no.3-负向:seq id no.5、正向:seq id no.4-负向:seq id no.5组合成4种同细胞表型状态评估器。
131.将经核酸合成的细胞表型状态评估器序列通过gibson assembly技术连接到clai
与agei双酶切线性化后的swb-blasticidin慢病毒载体骨架上。
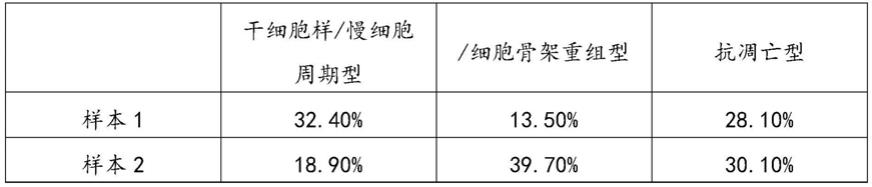
132.gibson操作步骤:
133.gibson assembly反应体系10μl:其中swb-blasticidin慢病毒载体骨架3μl,细胞表型状态评估器克隆片段1μl,混合酶6μl,50℃反应20min。
134.进行多重复合合成启动子肿瘤亚群覆盖效率评估:
135.(1)将三大类细胞表型状态评估器通过慢病毒载体形式均匀混合后感染待研究对象细胞,使用blasticidin筛选出稳转肝癌细胞系。
136.(2)用构建好的合成启动子慢病毒测试载体感染含有细胞表型状态评估器的稳转癌细胞系,使用puromycin筛选出合成启动子慢病毒测试载体与细胞表型状态评估器双重稳转癌细胞系。
137.(3)对上述双重稳转肝癌细胞系添加待研究的肿瘤药物,经过数天后,通过流式细胞术分析每种启动子的荧光报告基因mscarlet在eyfp、ebfp2和irfp表达细胞中的表达比例;也可通过流式细胞分选技术提取启动子mscarlet荧光与其它荧光重叠的细胞,扩增优化评估器上的barcode区域,得出该启动子可以标识出何种状态mirna所能代表的耐药细胞亚群。
138.(4)选择能够最大限度覆盖eyfp、ebfp2和irfp表达细胞的一套合成启动子,进行后续功能性基因电路构建实验。
139.检测方式:对合成启动子慢病毒测试载体与细胞表型状态评估器双重稳转肝癌细胞系mhcc97h进行化疗药物doxorubicin及靶向药物sorafenib处理,经过21天后,使用流式细胞仪检测各候选合成启动子所能代表的癌细胞亚群比例。如表1所示。
140.表1
[0141][0142][0143]
根据上述数据,以及各亚群最大化覆盖原则,在三启动子配置情况下选择样本7、样本8和样本9的候选启动子作为后续靶向多种耐药亚群治疗性基因电路的驱动元件;在四
启动子配置情况下选择样本6、样本7、样本8和样本9的候选启动子作为后续靶向多种耐药亚群治疗性基因电路的驱动元件。
[0144]
本发明通过对癌细胞进行耐药培养,从而获得多个不同的预选启动子,利用预选启动子构建启动子测试慢病毒,并结合不同的细胞表型状态评估器,从而基于癌细胞分别利用细胞表型状态评估器和启动子测试慢病毒进行感染获得双重稳转癌细胞系,并基于该双重稳转癌细胞系的耐药培养结果,判断何种预选启动子能够较高地识别多种亚型的癌细胞系,从而可以将该种预选启动子作为后续所构建的基因电路中的驱动元件。
[0145]
以上描述仅为本技术的较佳实施例以及对所运用技术原理的说明。本领域技术人员应当理解,本技术中所涉及的发明范围,并不限于上述技术特征的特定组合而成的技术方案,同时也应涵盖在不脱离发明构思的情况下,由上述技术特征或其等同特征进行任意组合而形成的其它技术方案。例如上述特征与本技术中公开的(但不限于)具有类似功能的技术特征进行互相替换而形成的技术方案。
